Авторы: Доценко И.А. 1 , Котомцев В.В. 2 , Медвинский И.Д. 3, 4 , Савельев А.В. 5 , Ботов М.А. 6
1 НИИФ — филиал ФГБУ «НМИЦ ФПИ» Минздрава России, Екатеринбург, Россия
2 ИИФ УрО РАН, Екатеринбург, Россия
3 УНИИФ — филиал ФГБУ НМИЦ ФПИ Минздрава России, Екатеринбург
4 ФГБОУ ВО УГМУ Минздрава России, Екатеринбург
5 УНИИФ — филиал ФГБУ «НМИЦ ФПИ» Минздрава России, Екатеринбург, Россия
6 ФГАОУ ВО «УрФУ им. первого президента России Б.Н. Ельцина», Екатеринбург, Россия
Введение
Стабилизация позвоночно-двигательных сегментов представляет определенные сложности, обусловленные особенностями биомеханики и анатомии пораженных и прилегающих к ним позвоночно-двигательных сегментов, что особенно актуально у пациентов со сформированной кифотической и/или сколиотической деформацией позвоночника на фоне спондилитов туберкулезной и неспецифической этиологии [1–9].
В настоящее время существует множество систем вентральной и дорзальной стабилизации позвоночно-двигательных сегментов, установка многих из них сопровождается травматизацией невральных структур [1–5, 7, 8, 10–16]. Одним из решений данной проблемы может служить применение технологии накостного остеосинтеза с фиксацией соседних позвонков персонифицированными титановыми пластинами, имеющими индивидуальный рельеф прилегающей к кости поверхности и встроенную систему навигации в виде отверстий с предварительно рассчитанными углами наклона, в которые по принципу минимально инвазивного проведения устанавливались винтовые фиксаторы. Пластины производились путем прототипирования на 3D-принтере с применением аддитивных технологий и с учетом особенностей анатомии позвоночно-двигательного сегмента экспериментального животного на основе первичных данных, полученных из пакета DICOM при мультиспиральной компьютерной томографии (МСКТ) пораженного сегмента позвоночника [17–19]. Применение персонифицированных титановых пластин, во-первых, обеспечивает тесное прилегание к любым анатомическим ориентирам и учитывает особенности структуры костной поверхности позвоночника, во-вторых, позволяет вводить винтовые фиксаторы по заранее рассчитанной траектории и существенно снижать риски их мальпозиции с перфорацией позвоночного канала и травматизацией невральных структур. В настоящей статье представлен опыт применения разработанной нами технологии в эксперименте при травматических поражениях позвоночно-двигательных сегментов у собак.
Целью исследования является изучение возможности применения предлагаемой нами технологии фиксации позвоночно-двигательных сегментов с элементами навигации в эксперименте на животных.
Материал и методы
Эксперимент получил одобрение этического комитета УНИИФ — филиала ФГБУ «Национальный медицинский исследовательский центр фтизиопульмонологии и инфекционных заболеваний» Минздрава России (протокол № 2 от 08.02.2018). Экспериментальное исследование было проведено на 20 животных (собаках разных пород) обоего пола, средний возраст — 3,5 года (95% ДИ 2,8–4,2), средняя масса тела — 32,4 кг (95% ДИ 29,3–35,5), с преимущественно схожим механизмом и последствиями травмы, приведшими к переломовывиху одного из грудных позвонков и грубому неврологическому дефициту по типу центрального парапареза с глубиной неврологических нарушений, оцененной по шкале Frankel [6] от А- до С-степени. По данной шкале степень A (F.A) — отсутствие двигательных и чувствительных функций ниже уровня травмы; степень B (F.B) — плегия, сохранена чувствительность или ее элементы; степень C (F.C) — выраженный парез (есть слабые движения), чувствительность сохранена; степень D (F.D) — cлабый парез, чувствительность сохранена; степень E (F.E) — отсутствуют чувствительные или двигательные нарушения (независимо от рентгенологической картины повреждения позвонков).
Животные содержались в одинаковых условиях передержки (в индивидуальных клетках, на однотипном рационе), получали стандартную послеоперационную терапию и курс реабилитации. В зависимости от метода фиксации позвоночно-двигательных сегментов животные были разделены на две сопоставимые (условия содержания, рост и вес животных, механизм травмы, степень неврологического дефицита по шкале Frankel) группы по 10 особей в каждой.
В контрольной группе до операции после сбора анамнеза и обследования животного формировался первичный план хирургического лечения, в соответствии с которым после ламинэктомии позвонки фиксировали при помощи полиаксиальных транспедикулярных винтов, без использования какой-либо навигационной системы.
У животных из основной группы эксперимент проводился по следующему плану в соответствии с разработанной технологией:
Сбор анамнеза и первичное обследование животного, проведение обзорных спондилограмм в прямой и боковой проекциях. Показаниями для проведения МСКТ являлись клинические и рентгенологические признаки нестабильного перелома или переломовывиха грудных позвонков.
Первичное сканирование на МСКТ, формирование пакета данных в DICOM-формате. Обработка техническим специалистом и нейроортопедом полученного пакета данных DICOM и формирование первичного плана хирургического лечения.
Обработка пакета данных DICOM, создание первичной трехмерной модели поврежденного сегмента позвоночника с разделением на отдельную модель передней опорной колонны (включающую в себя тело, диски и ножки тела поврежденного позвонка) и заднюю опорную колонну (нижние и верхние суставные отростки, поперечные и остистый отростки поврежденного тела позвонка) [4–6].
Формирование анатомических файлов: восстановленная модель передней опорной колонны, модель задней опорной колонны, формирование модели позвоночника с восстановленным сагиттальным балансом. Утверждение плана хирургического лечения.
Формирование на 3D-модели проекта виртуально имплантированного в модель набора каналов винтовой фиксации [8] (рис. 1).
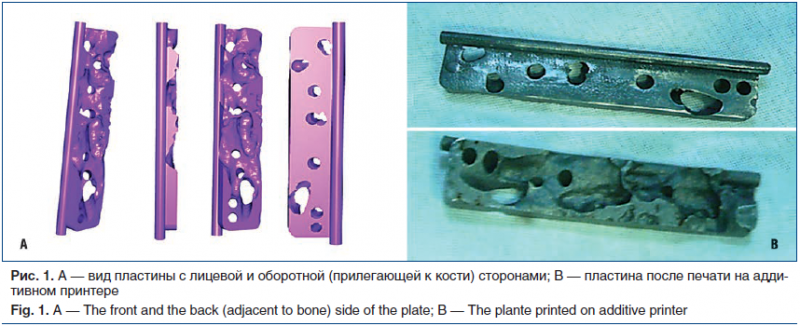
Сборка и формирование на основе построенных линий проведения винтов каналов-направителей и конечной персонифицированной модели пластины (рис. 2).

Печать персонифицированной пластины из пористого титана на 3D-принтере.
Стерилизация персонифицированной пластины и проведение хирургического вмешательства: задняя декомпрессия спинного мозга методом резекции дужки позвонков (ламинэктомия) с последующим скелетированием участка тел позвонков в месте установки пластины. На подготовленный участок накладывали персонифицированную пластину и фиксировали ее кортикальными винтами, после чего рану закрывали, используя рассасывающийся шовный материал. На кожу накладывали узловатый прерывистый шов из нерассасывающегося материала.
Исследование на предоперационном этапе включало: общий и биохимический анализы крови, рентгенографию и МСКТ позвоночного столба, оценку неврологического дефицита по шкале Frankel. После оперативного вмешательства все случаи мониторировались в динамике исследования в объеме общего и биохимического анализов крови, рентгенографии позвоночного столба, оценки неврологического дефицита по шкале Frankel в 1, 3, 10, 50 и 90-е сут после операции. МСКТ проводилась через 1, 3 и 6 мес. после хирургического вмешательства.
Статистический анализ проводился на базе программного обеспечения IBM SPSS Statistics 21.0. Количественные данные представлены в виде среднего и стандартного отклонения среднего (М±SD). С учетом небольшого объема совокупности для статистического анализа применяли методы непараметрической статистики. Сравнение результатов контрольной и основной групп проводили с использованием критерия Манна — Уитни для независимых наблюдений, т. к. распределение не соответствовало нормальному, а данные о степени неврологического дефицита на пред- и послеоперационном этапах для каждой из групп сравнивались с помощью критерия Вилкоксона для зависимых наблюдений. Уровень значимости был выбран α=0,05.
Результаты исследования
При сравнительном исследовании результатов общего и биохимического анализов крови животных в обеих группах на этапах мониторирования в послеоперационном периоде достоверных отличий не выявлено.
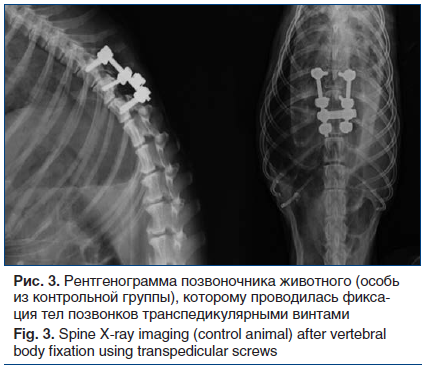
Рентгенограмма позвоночника животного из контрольной группы представлена на рисунке 3. По результатам рентгенографии и МСКТ позвоночного столба в послеоперационном периоде в контрольной группе у 3 (30%) животных на 1-е сут после операции была зафиксирована мальпозиция транспедикулярных винтов в позвоночный канал с развитием болевого синдрома, астенизации и невральных расстройств в виде дисфункции тазовых органов. На 90-е сут послеоперационного периода у 1 особи (10%) был зафиксирован перелом одного из транспедикулярных винтов с нестабильностью конструкции. У животных основной группы, по данным рентгенографии и МСКТ (рис. 4) позвоночного столба в послеоперационном периоде, отсутствовало вхождение винтов в позвоночный канал. По нашему мнению, мальпозиция возникла интраоперационно при установке транспедикулярных винтов.

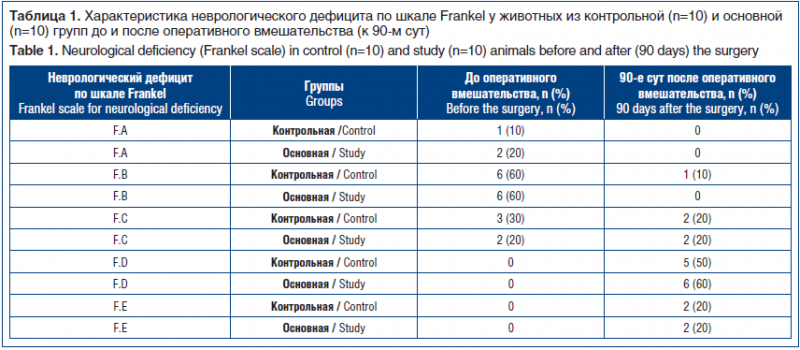
Оценку неврологического дефицита по шкале Frankel проводили на 90-е сут после операции и сравнивали с исходными показателями (табл. 1). На дооперационном этапе животные в обеих группах в отношении неврологического дефицита по шкале Frankel распределились на уровнях F.А, F.В, F.С практически симметрично. Об этом свидетельствуют данные сравнения по критерию Манна — Уитни (U-статистика 42,0, p-значение 0,26) для независимых наблюдений, позволяющие констатировать, что обе группы принадлежат к одной генеральной совокупности и не имеют статистически значимого сдвига относительно друг друга на дооперационном этапе. В обеих группах в послеоперационном периоде ни у одного из животных не выявлено прогрессирование неврологического дефицита. В контрольной группе на 90-е сут после операции у 2 (20%) особей достигнут максимальный регресс неврологического дефицита (F.E), у 5 (50%) — верифицирована F.D степень, в 1 (10%)
и 2 (20%) случаях выявлены F.В и F.С степени соответственно. Наиболее частым нарушением у животных (3 особи) этой группы были невральные расстройства в виде дисфункции тазовых органов (задержка мочи), требующие длительного послеоперационного выведения мочи разовым жестким уретральным катетером Нелатона. В основной группы на 90-е сут после операции у 2 (20%) особей достигнут максимальный регресс неврологического дефицита (F.E), у 6 (60%) — верифицирована F.D степень, в 2 (20%) случаях установлена F.С степень. Сравнение уровней неврологического дефицита у особей из основной группы на двух этапах выявило статистически значимый (критерий Вилкоксона для зависимых наблюдений T=0,0, p=0,004) его регресс в послеоперационном периоде (90-е сут).
Заключение
Фиксация позвоночно-двигательных сегментов с помощью персонифицированной титановой пластины с навигационными отверстиями позволяет избежать интраоперационной мальпозиции фиксирующих винтов с развитием болевого синдрома и неврологических расстройств; увеличить стабильность фиксации сегментов позвоночника и профилактировать переломы винтов за счет увеличения площади соприкосновения титановой пластины с костью; проводить фиксацию без применения дорогостоящих и потенциально опасных для пациента и персонала систем электронно-оптической рентгеновской визуализации. Полученные результаты позволяют сделать вывод о возможности и целесообразности применения технологии фиксации позвоночно-двигательных сегментов персонифицированными титановыми пластинами с элементами навигации, произведенными на 3D-принтере с применением аддитивных технологий и с учетом особенностей анатомии, в эксперименте на животных. Элементы разработанной технологии могут быть использованы в практике нейрохирургической клиники после окончания апробации метода в эксперименте.
Благодарность
Работа выполнена согласно темам НИОКР УНИИФ Минздрава РФ № 114032140001 и ИИФ УрО РАН № 01201352042. Авторы благодарят Центр коллективного пользования ИИФ УрО РАН за оказанную помощь в проведении эксперимента.



