Авторы: С.С. ГОРШКОВ, Н.В. УЛАНОВА, В.В. МАНУЙЛОВА, Ветеринарная клиника «Бэст», г. Новосибирск.
В.П. ИГНАТОВ, Е.А. СОЛДАТОВА, С.И. ТВЕРДОХЛЕБОВ, Национальный исследовательский Томский политехнический университет, г. Томск.
В данной работе рассмотрен клинический случай чрескожного остеоинтегрируемого протезирования (ЧОП) 4 конечностей протезами SerGoFIX у кота. Проанализировав данные баз MedLine и Googgle Scolar с запросами prosthesis, intraosseous transcutaneous, amputation нам не удалось найти упоминаний или единичных сообщений о каком-либо аналогичном опыте протезирования 4-х конечностей у собак или кошек. На основании этого данный клинический случай является первым в мире сообщением о применении данного метода с протезированием всех конечностей у одного животного с отдаленным наблюдением.
Актуальность
Данный клинический случай представляет опыт ЧОП конечностей у кота после перенесенной ампутации по поводу холодовой травмы. Подробное писание методики с примерами клинических случаев и отдаленными результатами было описано ранее (VetPharma,
№4-2017, «Чрескожное остеоинтегрируемое протезирование конечностей у собак и кошек», где представлен опыт использования протезов SerGoFIX – вживляемых внутрикостных индивидуальных имплантатов с биопокрытием (обработанных методом микродуго-
вого оксидирования с формированием кальций-фосфатного покрытия) различной конфигурации изготовленные с использованием аддитивной технологии 3D-печати металлом разработанных на базе ветеринарной клиники «Бэст» (г. Новосибирск) в сотрудничестве
с Национальным исследовательским Томским политехническим университетом.
Введение
Метод внутрикостного протезирования, основанный на принципе остеоинтеграции, который был предложен проф. Per-Ingvar Brånemark, является одним из перспективных направлений в современной реконструктивной хирургии и на сегодня является «золотым
стандартом» дентальной имплантации с 1970-х годов. Дальнейшее развитие методологии нашло свое применение в ортопедии, онкохирургии, сформировавшись в отдельное направление – чрескожное остеоинтегрируемое протезирование конечностей после
перенесенной ампутации. В гуманной медицине данный подход позволяет достичь более высоких показателей функциональной активности пациентов, а также повысить качество жизни по сравнению с традиционной технологией с использованием протезов с культе-
приемной гильзой. Для животных данный метод может быть альтернативой полной ампутации при травматических, неопластических поражениях дистальных сегментов конечностей, а также при врожденных деформациях с достижением функциональных результатов
в виде полноценной опороспособности в сравнении со стандартной калечащей процедурой ампутации.
История болезни
В ВК «Бэст» 11.03.17 по направлению из сторонней клиники поступил пациент на ЧОП: кот, метис по кличке «Рыжий», вес 4.5 кг., предположительный возраст 5 лет с диагнозом «холодовая травма грудных, тазовых конечностей и ушных раковин». В сторонней клинике
ранее была выполнена частичная ампутация на уровне плюсневых фаланг и резекция пораженных ушных раковин. При проведении общего клинического и орто-неврологического осмотра было выявлено общее стабильное состояние, отмечалось поражение пястных фаланг грудных конечностей по типу сухого некроза с четкой демаркационной линией и болевым синдромом при пальпации области поражения (рис. 1).
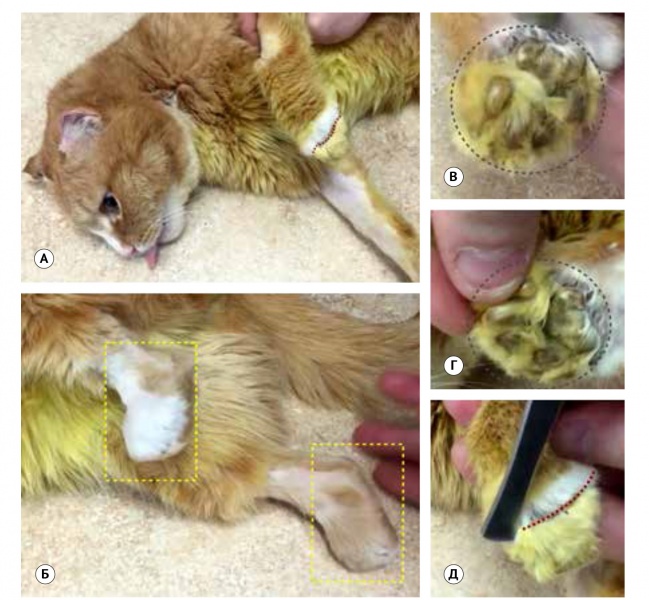
Рис. 1. Внешний вид пациента с поражениями дистальных сегментов грудных конечностей по типу сухого некроза (отмечено кругом) в результате перенесенной холодовой травмы. А – красной линией и кругом отмечена демаркационная зона на уровне пястных костей и запястья слева (А, В) и справа (Г, Д). Уровень ранее перенесенной ампутации тазовых конечностей выполнен на уровне плюсневых костей (Б).
Диагностика
Диагностический план включал общий/биохимический анализы крови, УЗИ сердца, рентгенологическое исследование, компьютерную томографию (КТ) грудных и тазовых конечностей. По результатам рентгенологического обследования данных по поводу остеомиелита получено не было. По результатам клинического и биохимического исследования крови не было выявлено значимых отклонений.
Предоперационное планирование
По данным КТ было выполнено предоперационное планирование, которое включало оценку структуры костной ткани, замеры диаметра кости и интрамедуллярного канала, области имплантации (дистальная часть лучевой кости, дистальная часть большеберцовой кости) (рис. 2). Для предоперационного планирования и разработки 3D-моделей эндопротезов и индивидуальных (персонифицированных) хирургических направителей (гайдов) (ПХН) использовалось программное обеспечение Polygon Medical Engineering.
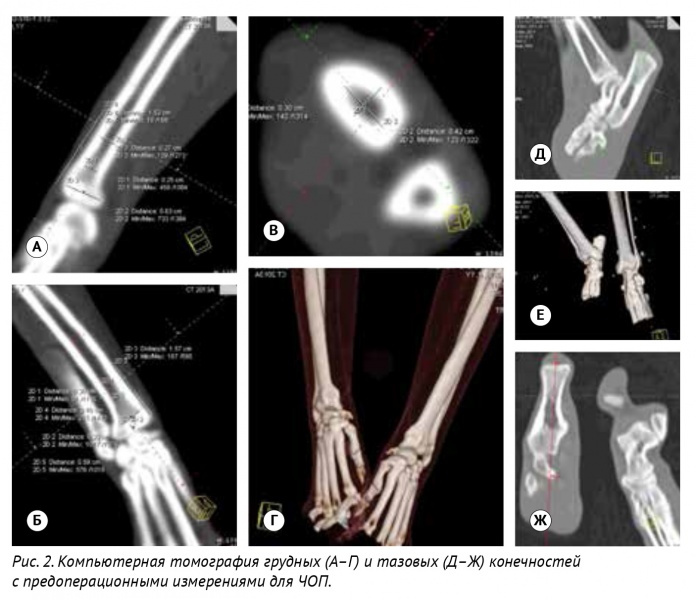
Алгоритм предоперационного планирования включал:
1. КТ грудных и тазовых конечностей пациента с последующей загрузкой исходных данных (DICOM-файлы) в программу планировщик Polygon. Дальнейшее планирование и редактирование 3D-модели выполняется непосредственно в программе-планировщике.
2. Сегментация костей конечности области интереса биоинженером (прим.: Сегментация – Segmentation – выделение интересующих органов, костей и их границ с последующей их визуализацией, анализом (измерение объема, площади поверхности) или с последующим экспортом в каком-либо виде в качестве полигональной модели при необходимости.
3. Обозначение уровня резекции сегмента кости (опил кости) хирургом с последующим позиционированием конечности под требуемый угол с устранением ротации, сохранением длины и оси конечности.
4. Создание эскиза требуемого индивидуального имплантата путем его отрисовки хирургом на поверхности кости; расстановка и выбор диаметра, длины и типа требуемых под имплантат винтов.
5. Создание и утверждение позиционных индивидуальных гайдов (ПХН) для формирования ИМ-канала, уровня дистального опила кости.
6. Редактирование и утверждение проекта.
7. Изготовление индивидуальных ЧОИП и персонифицированных ПХН методом аддитивного производства.
Материалы и методы
Изготовление индивидуальных ЧОИП и экзопротезов было выполнено методом аддитивного производства с использованием следующее оборудования: для 3D-печати металлом в одной серии использовалась аддитивная машина (3D-принтер) Concept Laser M2
cusing с технологией (Laser CUSING (SLM – Selective Leser Melting)) лазерного селективного плавления металлических порошков (выборочная лазерная плавка) с использованием материала титановый сплав ((Ti6AI4V), класс металлообработки – 5). Другая серия имплантатов была изготовлена по параметрической цифровой модели методом прямого лазерного спекания металлов (Direct Metal Laser Sintering, DMLS; EOS M 290) с использованием материала Ti-6Al−4V. В процессе лечения данного пациента всего было разработано 3 конфигурации ЧОИП (SerGoFIX тип 1, 2, 3; далее SF) которые будут представлены ниже.
Изготовление индивидуальных одноразовых ПХН для формирования ИМ-канала и введения винтов через ПХН-кондуктор, выполняли методом стереолитографии (3D-печати) используя 3D-принтер Formlabs Form 2 из биосовместимого фотополимера Dental SG.
Конфигурация ЧОИП первого типа (SF-1) представлена интрамедуллярным стержнем диаметром 3,5 мм блокируемого винтами 1,5 мм с кальций-фосфатным покрытием с наружным ИМ-стержнем с последующим креплением экзопротеза (5 мм.) (рис. 3).

Рис. 3. Концепция конфигурации ЧОИП – SF-тип 1 в планировщике Polygon для грудных и тазовых конечностей (аналогичные модели). Вид спереди (А), медиально в режиме «прозрачности» (Б, В).
Рис. 4. Изготовленные ЧОИП – SF-тип 1. (прямое лазерное спекание металлов с постобработкой). ЧОИП до микродугового оксидирования (А) и после нанесения кальцийфосфатного покрытия (Б, В, отмечено контуром).
Все части ЧОИП-SF области контакта с костной тканью всех конфигураций имели пористые (абразивные) части и были обработаны методом микродугового оксидирования с формированием кальций-фосфатного покрытия, разработанных Национальным исследовательским Томским политехническим университетом (рис. 4).
Экзопротезы были индивидуально разработаны и изготовлены на основании 3D-печати мастер-модели (отливная форма). Внутренняя фиксирующая к ИМ-стержню часть изготовлена токарно-фрезерным методом (ЧПУ СТХ 310 ecoline V3) с последующей заливкой силиконом (литьевой силикон) в напечатанной пресс-форме, изготовленной методом прямого лазерного спекания металлов (рис. 5). Данные модели экзопротезов по опыту авторов более универсальны, менее подвержены самопогрызанию со стороны пациентов и позволяют выполнять смену части экзопротеза по мере его изнашивания.
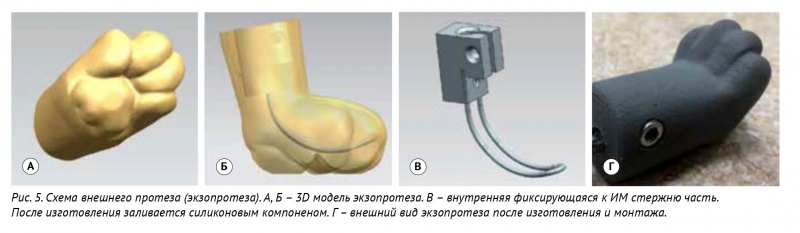
Рис. 5. Схема внешнего протеза (экзопротеза). А, Б – 3D модель экзопротеза. В – внутренняя фиксирующаяся к ИМ стержню часть. После изготовления заливается силиконовым компоненом. Г – внешний вид экзопротеза после изготовления и монтажа.
Анестезиологический протокол
Периоперационную антибиотикопрофилактику выполняли с использованием препарата цефазолин (30 мг/кг, однократно) за 30 минут до оперативного доступа. Далее повторное введение при длительности оперативного вмешательства дольше 90 минут. Использовали мультимодальную комбинированную анестезию (МКА). Индукцию выполняли препаратом пропофол 6-8 мг/кг болюсно, далее золетил в дозе 4 мг/кг. Далее поддерживающая доза пропофола составляла 10-12 мг/кг/час. Вводную индукцию осуществляли ручным, болюсным введением препаратов, в дальнейшем индукцию проводили, используя шприцевой двухканальный дозатор фирмы Sensitec SN-50F6, SinoMDT. При ЧОП тазовых конечностей во всех случаях использовали эпидуральную анестезию препаратом ропивакаин 2 мг/кг, с поддерживающей дозой пропофола 10-12 мг/кг/час. Мониторинг осуществлялся с помощью кардиомонитора Vet Monitor iOCARE iM 12E, а также оценивались следующие показатели гемодинамики: ЧСС, ЭКГ, ЧДД, НАД, SpO2, Т. Степень анестезиологического риска у оперируемого животного соответствовала 2-му классу по классификации ASA.
Хирургическая техника. Этап 1
Процедура ЧОП была выполнена в 2 этапа: 1-й этап – протезирование грудных конечностей и 2-й этап – протезирование тазовых конечностей с интервалом в 2 недели.
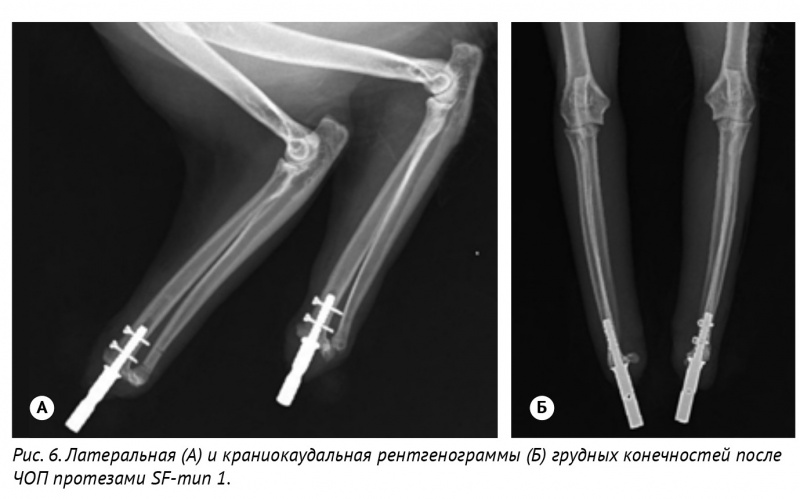
На грудных конечностях была выполнена экзартикуляция на уровне лучезапястного сустава с дальнейшей имплантацией эндопротезов 1-го типа в левую и правую лучевую кости (рис. 6). При формировании и римировании канала правой лучевой кости ятрогенно была допущена перфорация ИМ-канала лучевой кости на краниальной поверхности дистального сегмента лучевой кости.
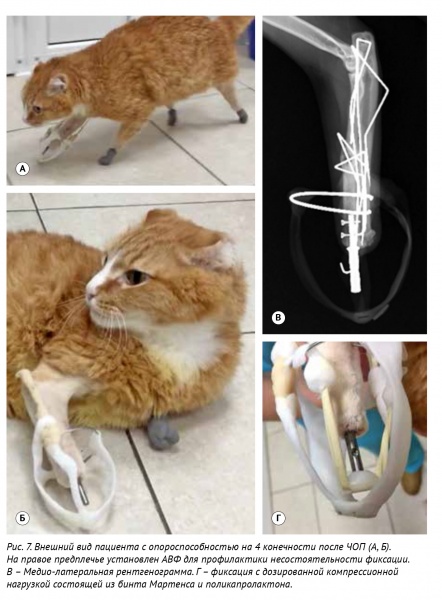
Для профилактики несостоятельности фиксации после протезирования правой лучевой кости ввиду развития данного интраоперационного осложнения была выполнена временная установка аппарата внеочагового фиксатора (АВФ) с акриловым полимером (конфигурация IIа) для защиты ЧОИП от ранней нагрузки. Используя композит из поликапролактона была выполнена 3-х опорная фиксация в виде «купола» с креплением на экстернальный аппарат (рис. 7). АВФ был демонтирован через 21 день. Послойное ушивание раны с формированием мышечно-кожной культи выполняли во всех случаях. На мягкие ткани (мышцы, п/к клетчатку) накладывали простой узловатый шов, используя адсорбирующий монофиламентный шовный материал (Моносорб) 3.0, 4.0 metric.
Хирургическая техника. Этап 2
На тазовых конечностях была выполнена экзартикуляция на уровне проксимального межплюсневого сустава по аналогичной методике ЧОП грудных конечностей через 2 недели.
В процессе римирования ИМ-канала (последовательное рассверливание канала вращательными движениями сверла или специального инструмента, обеспечивающие его расширение для минимизации ятрогенного перелома кости с последующей плотной посадкой эндопротеза) и при попытке последующей имплантации эндопротеза были выявлены трещины пяточной кости на всем протяжении в результате чего было принято решение выполнить более высокую ампутацию с последующей имплантацией ЧОИП в большеберцовую
кость (рис. 8, 9).
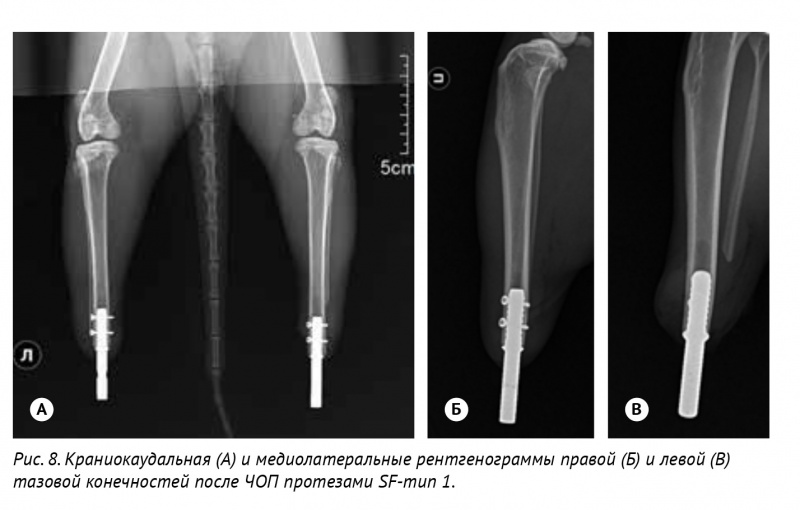

Рис. 9. Внешний вид пациента с опороспособностью на все конечности после ЧОП (А). Б – Внешний вид грудных конечностей через 7 месяцев.
Послеоперационный период
В послеоперационном периоде во всех случаях применяли антибактериальную терапию и анальгезию. Послеоперационная терапия включала в себя применение препаратов мелоксикам однократно 0,2 мг/кг, предоперационно, далее 0,02–0,05 мг/кг, 1 р/сут., курс 14 дней.
Стоит отметить, что по результатам многих исследований, мелоксикам безопасно переносится кошками при длительной терапии до 4-х недель и более [1]. Также использовали препарат Робенакоксиб: 1-2 мг/кг, (PerOs), 1 раз в сутки. В послеоперационный период были выполнены назначения: амоксициллин + клавулановая кислота (синулокс) 20 мг/кг, 2 раза в день. Стандартный курс при отсутствии осложнения в виде несостоятельности швов – 10 дней. При развитии инфекционных осложнений – курс до заживления ран.
Оценка результатов.
Послеоперационный рентгенологический контроль выполнялся в соответствии с разработанным авторами работы протоколом наблюдений за пациентами после ЧОП. Протокол включает оценку ЧОИП в день операции, далее через 1/4/6/10/12 месяцев, далее с интервалом в 6 месяцев, а также при необходимости в случае развития осложнений или усилении хромоты на протезированные конечности.
Оценка кожной интеграции выполнялась клинически на основании физикальных методов обследования. Оценивались такие параметры как трансдермальный контакт протеза (в норме нет признаков патологической подвижности при тесте на ротацию, покраснения,
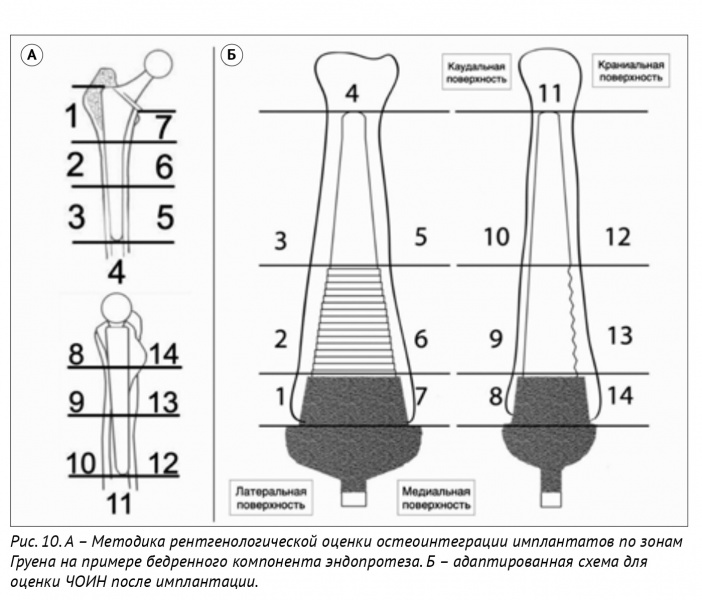
выделений), болевой синдром при пальпации, гиперемия, наличие отделяемого. Для объективной оценки реакции костной ткани на протез, степени остеолиза, миграции имплантатов выделяют зоны проекции эндопротеза на основании данных рентгенограмм по Груэну для описания костных изменений вокруг эндопротезов (перипротезной области) в 14 зонах [2] (рис. 10).
Динамическое наблюдение.
Грудные ЧОИП
Функциональная опороспособность отмечалась на 5-й день после ЧОП грудных конечностей. Кожная интеграция отмечалась через 4 недели. Купирование болевого синдрома при пальпаторной оценке происходило в среднем через 6–7 недель.
Признаков нестабильности лучевых ЧОИП не было выявлено. Остеоинтеграция клинически и рентгенологически была достигнута через 6 недель. Через 7 месяцев отмечалась полноценная опороспособность без признаков остеолизиса ЧОИП (рис. 11). Через 8 месяцев
с момента первичного ЧОП была отмечена острая хромота на левую грудную конечность, исходя из анамнеза «при прыжке с дивана».
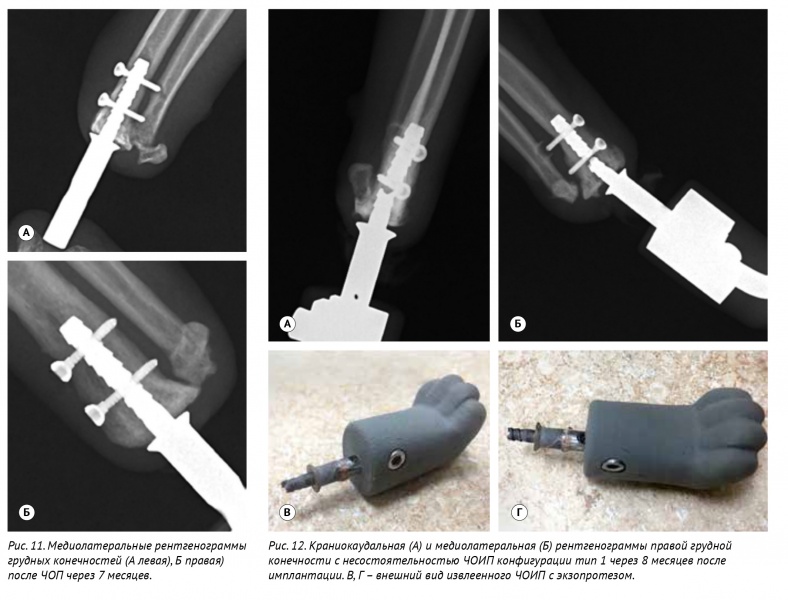
Рис. 11. Медиолатеральные рентгенограммы грудных конечностей (А левая), Б правая) после ЧОП через 7 месяцев.
Рис. 12. Краниокаудальная (А) и медиолатеральная (Б) рентгенограммы правой грудной конечности с несостоятельностью ЧОИП конфигурации тип 1 через 8 месяцев после имплантации. В, Г – внешний вид извлеенного ЧОИП с экзопротезом.
По результатам контрольного рентгенографического исследования грудных конечностей был выявлен перелом интрамедуллярной части левого ЧОИП (рис. 12). Была выполнена ревизия несостоятельного ЧОИП. В данный период репротезирования также была выявлена несостоятельность тазовых ЧОИП (подробное описание ниже).
Для разработки новой 3D модели и изготовления ЧОИП конфигурации тип 2 для тазовых (описано ниже) и тип 3 для грудной коненчости, а также индивидуальных (персонифицированных) хирургических направителей была выполнена повторная КТ грудных и тазовых конечностей, загрузка данных в программу планировщика с последующей 3D-печатью.
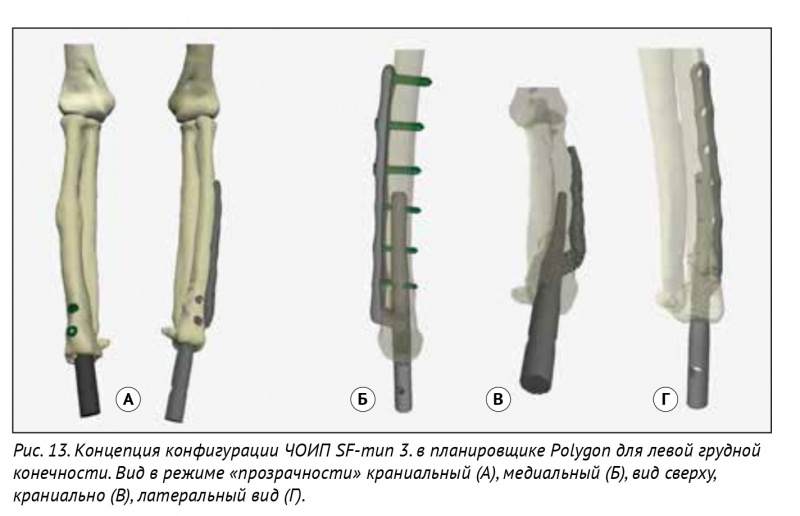
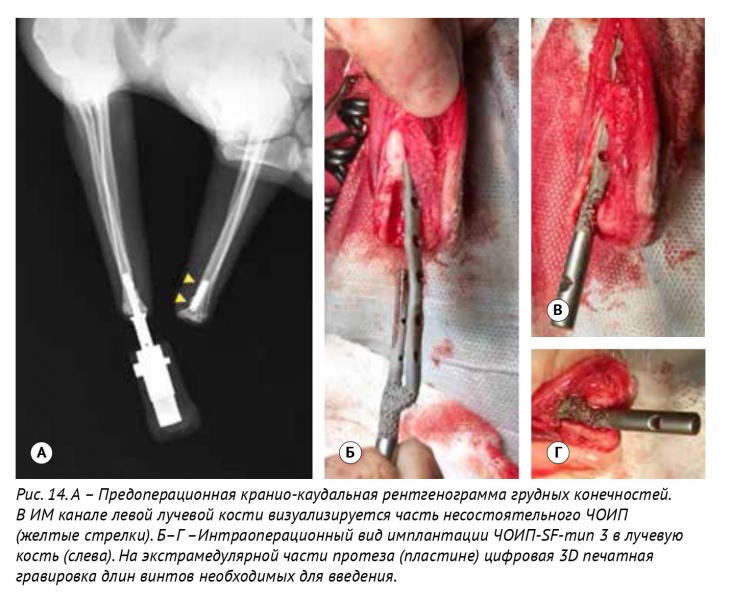
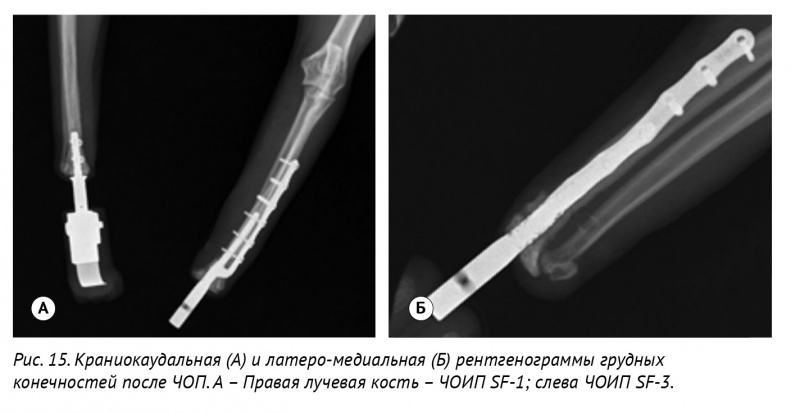
Конфигурация ЧОИП-SF-тип 3 для протезирования левой грудной лучевой кости после перенесенного перелома эндопротеза была разработана в виде ИМ-блокируемого стержня в сочетании с пластиной под винты 1,5 и 2,0 мм. ИМ-часть данных эндопротезов повторяет вид ИМ-канала лучевой кости и фиксируется методом «плотной посадки» (press-fit) (рис. 13). После процедуры микродугового оксидирования ЧОИП было выполнено ЧОП (рис. 14), (рис. 15).
Продолжение следует.



