В продолжение опубликованных в журнале «Аддитивные технологии» № 2 2020 и № 3 2020 первых частей данной статьи остановимся на дополнительных возможностях биопечати для медицины и создания продуктов питания, путях развития новых синтетических материалов, определяющих новые применения, а также на многочисленных аспектах внедрения биопроизводства, кардинально меняющего привычные устои жизнедеятельности человека.
Биопечать костей
Костная ткань состоит из двух различных структур — пористой внутренней и прочной наружной, которые находятся в процессе изменений и роста и могут поддерживать циклы ремоделирования и регенерации за счет взаимодействия между остеобластами, остеоцитами и клетками остеокластов. Однако возможности самовосстановления и восстановления при крупномасштабных костных дефектах ограничены. Наиболее перспективной процедурой лечения таких дефектов является 3D-печать каркасов благодаря ее способности изготавливать индивидуальные каркасы с заданной геометрией, контролируемыми химическими и механическими характеристиками.
Для выращивания костных тканей используют прочные синтетические полимеры типа Polycaprolactone (PCL) и природные минералы, такие как hydroxyapa-tite (HAp) [1, 2, 3]. Они показывают хорошую биосовместимость, высокие механические свойства, регулируемую биодеградацию и легко адаптируются к 3D-печати. В частности, гидроксиапатит (HAp) успешно используется при печати протезов суставов и зубных имплантатов в силу их высокой биоактивности, что обеспечивает успешную остеоинтеграцию. Чернила из керамики для печати можно условно разделить на три группы:
– на основе фосфатов кальция,
– на основе силикатов кальция,
– на основе биоактивного стекла (например, боросиликатное стекло).
Каркасы из биоактивной керамики могут стимулировать дифференциацию и развитие стромальных клеток костного мозга, что улучшает процесс выращивания новой костной ткани. В ряде работ показано позитивное влияние легирующих добавок металлов в керамические чернила, таких как Zn, Sr, Mn, Mg [4].
Биочернила на основе синтетических полимеров используются для выращивания каркасов для регенерации костных тканей за счет их заполнения клетками фибробластов костной ткани. В сочетании с металлическими порошками композитные полимерные чернила позволяют выращивать недеградирующие каркасы и имплантаты для конкретного пациента. Достоинства композитных чернил в том, что они адаптированы для печати каркасов на биопринтерах, придают каркасам более высокие механические и биотехнологические характеристики. Примером такого рода чернил служит композитный материал, состоящий из 60% HAp и 40% β-TCP (HAp-TCP: Hydroxyapatite and tricalcium phosphate) с антибактериальным покрытием из пероксида кальция [5].
В работе [6] авторы показали пример изучения раковых заболеваний кости на матрице костной ткани (рис. 1).
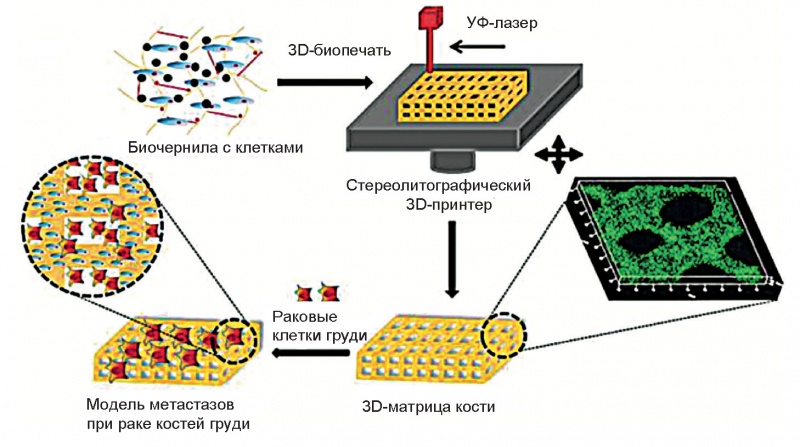 Рис. 1. Схема для изучения взаимодействия раковых клеток груди с костными стромальными клетками
Рис. 1. Схема для изучения взаимодействия раковых клеток груди с костными стромальными клетками
Лечение повреждений суставов
Повреждения суставов, вызванные травмами и спортом, всег-да перерастают в остеоартроз (ОА); таким образом, ОА является основной причиной остеохондрального дефекта [7]. К 2030 году около 67 миллионов американцев будут страдать от ОА. В естественных структурах остеохондральной ткани суставной хрящ хорошо интегрирован с субхондральной костью, и дефекты хряща всегда глубоко проникают в субхондральную кость и в дальнейшем развиваются в остеохондральные
дефекты. Ранее регенерация остеохондральных дефектов была в основном сосредоточена на хрящевом слое. В настоящее время для лечения остеохондрального дефекта доступны хирургические вмешательства, такие как микроразрушение, аутотрансплантация и замена сустава. Хотя эти методы лечения могут уменьшить боль и улучшить качество жизни пациентов, не существует хирургической терапии, которая могла бы способствовать полному заживлению остеохондральных дефектов, особенно для полной регенерации хряща. Для решения этой проблемы было предложено несколько материалов для выращивания биоактивных каркасов для регенерации как хряща, так и субхондральной кости.
Большинство материалов, предназначенных для регенерации хрящевого слоя, представляют собой органические вещества, включая полимеры и материалы на основе ECM. Полимеры, используемые в хрящевом слое, можно разделить на природные полимеры (желатин, хитозан, гиалуроновая кислота, коллаген, альгинат, гликозаминогликан, крахмал и бактериальные полимеры) и синтетические полимеры (Поли- (D, L-молочно-гликолевая кислота), поликапролактон, полиэтиленгликоль и полигликолевая кислота). Природные полимеры обладают низкой жесткостью и слабой биомеханикой, синтетические полимеры имеют контролируемую кинетику разложения и регулируемые механические свойства. С учетом требований механики к субхондральной кости обычно применяются материалы с достаточной прочностью на сжатие, такие как металлические материалы (титан и его сплавы, сплав кобальт-хром и нержавеющая сталь), биостекло и биокерамика, показывающие в т. ч. высокую интеграцию с костной тканью. Это может быть биоинертная керамика, такая как фарфор и диоксид циркония; биоактивная керамика, которая обладает разумной вязкостью разрушения и химической коррозионной стойкостью или износостойкостью после имплантации, и биодеградируемая керамика [8], которая содержит фосфаты кальция, карбонаты кальция, силикаты кальция (рис. 2). Кроме того, натуральные и синтетические полимеры, имеющие подходящую несущую способность, могут сочетаться с металлическими материалами и биокерамикой или использоваться отдельно для разработки субхондральной костной ткани.
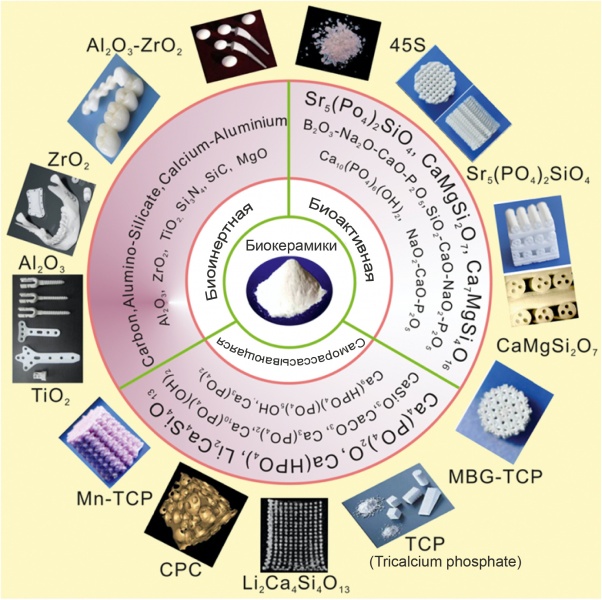 Рис. 2. Биокерамика для печати
Рис. 2. Биокерамика для печати
3D-печать может использоваться для подготовки каркасов с однородными порами для регенерации хрящей и субхондральных костей. Напечатанные каркасы могут иметь любую форму и обеспечивают взаимосвязанную макро- и микропористость, а также гетерогенность и анизотропию, чтобы удовлетворить требованиям механических параметров для инженерии остеохондральной ткани. Идеальные биоактивные каркасы, подготовленные для облегчения и усиления регенерации остеохондры, должны обладать способностью воспроизводить естественную архитектуру и физиологические свойства суставного хряща и тканей субхондральной кости. Чтобы имитировать иерархические структуры остеохондральной ткани, были изготовлены двухфазные и многослойные каркасы. Однако биологически имитировать первоначальные структуры остеохондральной ткани трудно, и применение двухфазных и многослойных каркасов в клиниках ограничено неоднородными механическими реакциями и низкой адгезионной прочностью между двумя соседними слоями.
В настоящее время большинство материалов, используемых в хрящевом слое, представляют собой полимеры и ЕСМ, а материалы, применяемые в субхондральном слое кости, представляют собой металлические материалы, биокерамику и биостекла.
Основной проблемой является разработка биоактивных каркасов или передовых стратегий, которые могли бы полностью копировать природную архитектуру и функцию остеохондральной ткани и создать интерфейс, который структурно и физиологически имитирует хрящ и субхондральную кость.
Протезы
Протез — это прибор, созданный для замены отсутствующей части тела или для улучшения функциональности других частей тела. Наиболее известны протезы рук, кистей рук, ног (рис. 3), суставов, глаз, а также зубов и отдельных частей челюстей. Использование 3D-печати для создания протезов предпочтительно по сравнению с традиционными технологиями из-за того, что протез любой сложности конструируется под конкретного пациента, он легкий и его стоимость невысока. Например, протезы ног с использованием АМ успешно изготавливаются несколькими компаниями: BionX Medical Technologies, Inc. (Массачусетс, США); Exo-Prosthetic Leg (Калифорния, США); Andiamo (Лондон, Великобритания).

 Рис. 3. Биопротезы конечностей компании Ottobock (www.ottobock.com/en/): руки, управляемой командами головного мозга, которые считываются датчиками на руке с протезом и приводят в движение соответствующие приводы кисти и пальцев (а), ноги с управлением опциями (б)
Рис. 3. Биопротезы конечностей компании Ottobock (www.ottobock.com/en/): руки, управляемой командами головного мозга, которые считываются датчиками на руке с протезом и приводят в движение соответствующие приводы кисти и пальцев (а), ноги с управлением опциями (б)
Протез глаза с 3D-печатью (рис. 4) разрабатывается компанией Fripp Design and Research (Лондон, Великобритания). Выгоды очевидны: существенное сокращение времени изготовления (с 4–8 ч на один протез глаза до 150 глазных протезов в час), снижение стоимости на 97% (от 3000 до 100 фунтов стерлингов).
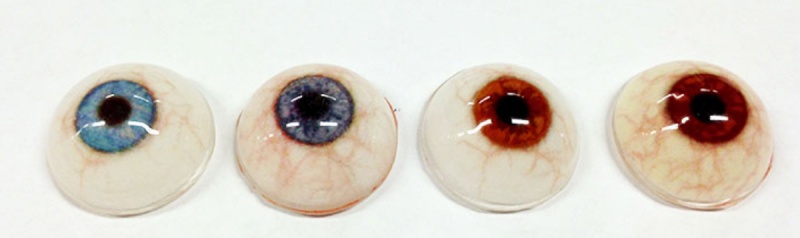
Рис. 4. Напечатанный протез глаза
3D-протезы лица также являются еще одним приложением, где пациенту устанавливают отпечатанные части взамен утраченных в результате травмы или заболевания.
Еще одно успешное применение — для лечения гипертрофических рубцов на лице после глубоких ожогов использовалась прозрачная маска для лица, изготовленная с использованием 3D-принтера OBJET MED610 (Stratasys, USA) и облицованная двумя слоями прозрачного медицинского силиконового геля для выравнивания давления на лицо со стороны маски [9]. Маску необходимо было носить не менее 20 часов в сутки, при этом позитивные результаты проявились уже через месяц, и через полгода стало очевидно, что 3D-печатная маска для лица является эффективным методом лечения с уменьшением средней толщины рубца после ожогов и уменьшением количества клинических процедур, что облегчает лечение и сокращает время, затрачиваемое на эти процессы [10].
По оценкам экспертов, количество людей с утраченными конечностями к 2050 г. увеличится с 1,6 млн человек до 3,6 млн только в США. Поэтому спрос на протезы, как и на обучение пациентов, как ими пользоваться, только возрастает. Особенно это важно для детей в период их роста и проявления интереса к использованию различных инструментов, занятий спортом и т. д. Спроектированные и отпечатанные протезы должны быть доступны, изготавливаться для конкретного пациента, легко ремонтироваться и обслуживаться и настраиваться под разные виды деятельности.
Пока прямое взаимодействие протеза с головным мозгом невозможно, но исследования в этом направлении активно продолжаются (см. проект И. Маска Neu-ralink, www.neuralink.com). Появление технологии 3D-биопечати открывает новые возможности в создании клеточных протезов, включенных в единую коммуникационную систему: мозг — компьютер — протез.
Другая сложность имплантации тканей и органов для детей связана с ростом организма, соответственно, и имплантат должен расти и развиваться. В противном случае будет необходимо периодически заменять его, что достаточно сложно и несет с собой дополнительные риски. И здесь решение может быть найдено в области 4D-печати: напечатанные объекты в 3D со временем могут менять свою форму под действием различных факторов (температуры, pH среды и т. п.). Такие материалы для печати уже созданы [11], например, в компании Antleron (Бельгия), в которую компания 3D Systems (США) инвестировала свои 3D-технологии: 3D-принтеры, специальные программы для печати биоматериалами 3D Sprint и 3DXpert, а также более 20 биосовместимых материалов, в основном на основе коллагена с клетками.
Пока 4D-технологии находятся на ранней стадии в исследовательских центрах, но уже понятно, что они смогут обеспечить хирургов и медиков новыми инструментами от создания кожи для замены до объектов, изменяющихся под воздействием окружения. По оценкам, рынок 4D-печати для охраны здоровья вырастет со скромных $9 млн в 2021 до $32 млн в 2026 году. Материалы с изменяющейся формой могут применяться при создании миниатюрных имплантируемых медицинских приборов.
Биопечать в России
3D Bioprinting Solutions — лаборатория биотехнологических исследований, основанная крупнейшей частной медицинской компанией в России INVITRO. Деятельность лаборатории — разработка и производство биопринтеров и материалов в области трехмерной биопечати, разработка новых технологий в биопроизводстве и лекарственных препаратов [12]. Научным руководителем лаборатории стал один из признанных пионеров роботизированного биопроизводства, профессор инженерной школы Департамента химико-биологической инженерии государственного университета штата Вирджиния (США) Владимир Миронов (рис. 5).

Рис. 5. Научный руководитель лаборатории 3D Bioprinting Solutions В. А. Миронов
В 2014 году в компании 3D Bioprinting Solutions был создан первый российский биопринтер FABION собственной оригинальной конструкции и дизайна (рис. 6). В 2015 году там же был напечатан и успешно трансплантирован органный конструкт щитовидной железы мыши.


Рис. 6. Биопринтер «Фабион»
Год спустя был создан обновленный вариант биопринтера FABION, который имеет новый интерфейс, новое программное обеспечение, головку для двухкомпонентной печати и многое другое. Следующий принципиально новый биопринтер, который использует технологию магнитной левитации и позволяет производить самосборку микротканей и микроорганов из тканевых сфероидов, был представлен в Сколково 12 апреля 2016 г. на симпозиуме «Биофабрикация в космосе». По соглашению с госкорпорацией «Роскосмос» о проведении космического эксперимента по биофабрикации на борту российского сегмента МКС был разработан биопринтер «Орган.Авт» (рис. 7). Сам эксперимент под названием «Магнитный биопринтер» на Международной космической станции космонавт Олег Кононенко провел в декабре 2018 года. Его результатами стали органные модели хряща и щитовидной железы.
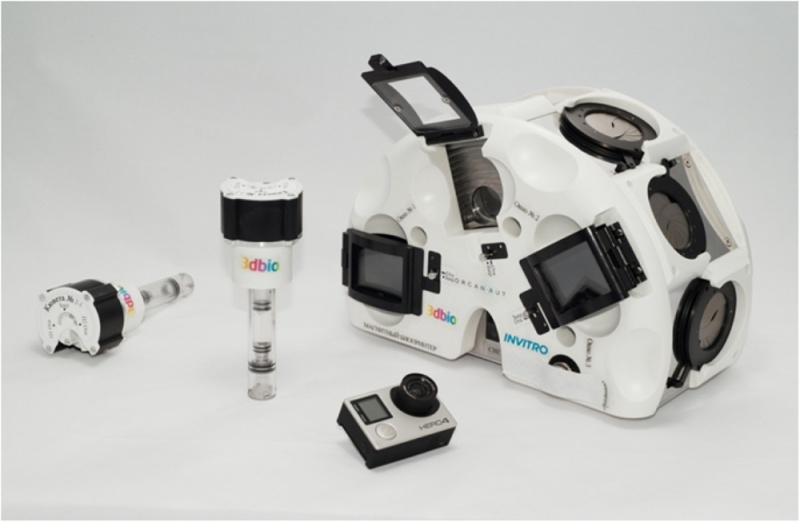 Рис. 7. Биопринтер «Орган.Авт»
Рис. 7. Биопринтер «Орган.Авт»
Революционные направления в биопроизводстве
Применение биотехнологии в следующих направлениях приведет к кардинальному изменению индустрии питания и ряда других приложений:
— искусственное производство кожи (производство одежды, обуви, парфюмерия, экспериментальная медицина);
— производство мяса (дешевое, $5/кг, более здоровое, с улучшенным вкусом и питательными свойствами, из мышечных клеток практически любых животных);
— не нужны в огромных количествах животные для лабораторных опытов.
Ресурсоэффективные биотехнологии приведут к сокращению производства скота, который занимает до 30% земной поверхности и генерирует до 24% глобальных выбросов парниковых газов.
В этом случае инновационный процесс может быть классифицирован как радикальный, поскольку создание будущих предлагаемых продуктов включает в себя высокий уровень новой технической компетенции, не похож на что-либо еще, в настоящее время существующее на рынке, и может оказать преобразующее влияние на современные методы производства.
Технологии биопечати эволюционировали от существующих технологий 3D-печати путем модификации используемых материалов и механизмов их нанесения и потому являются рутинными.
А вот производство кожи и мяса, которое, несмотря на использование традиционных биотехнологий, направлено на нетрадиционные применения, является революционным. Также инновационный фактор добавляется компаниями, осуществляющими 3D-биопечать, за счет кастомизации. Это можно считать ранним типом бизнес-модели системы «продукт-сервис», в которой клиенту предлагается интегрированное решение, включающее как конечный продукт (персонализированный имплантат), так и услугу персонализации, необходимую для создания продукта. Все остальные бизнес-модели, используемые компаниями, связанными с биотехнологиями, в основном сосредоточены либо на предоставлении оборудования для биопечати — как и любого другого лабораторного оборудования, либо на предоставлении услуг в области НИОКР.
В соответствии с системой классификации (Utterback и Abernathy) [13], биопроизводство можно рассматривать как все еще проходящую начальную и/или переходную стадию инноваций.
Индивидуальные биоразлагаемые имплантаты, разрабатываемые в течение нескольких десятилетий в тандеме со стандартизованными металлическими имплантатами для персонального применения, являются единственными продуктами, которые можно считать близкими к стандартизации. Кроме того, нормативные ограничения вынуждают эти продукты плотно вписывать в существующие стандарты, ускоряя коммерциализацию в медицин-
ских целях. Помимо бизнеса биопринтеров, который находится на ранней переходной стадии из-за относительной простоты своих продуктов, все другие виды биотехнологического бизнеса переживают период развития. Такие продукты и услуги по-прежнему сильно различаются и постоянно изменяются на ранней стадии развития, часто между лабораторией и рынком.
В статье [14] обсуждаются вопросы коммерциализации биопроизводства в таких областях, как здоровье, питание, производство тканей (текстиль).
Биопроизводство продуктов питания
Бизнес-модель биотехнологического производства продуктов питания для потребления человеком требует нормативного контроля, который является неопределенным и часто задерживает коммерциализацию новых биотехнологических продуктов. Однако некоторые прецеденты дают основания для оптимизма, например, мясо, полученное из клонированных животных, которое, несмотря на его новизну, было одобрено FDA и Министерством сельского хозяйства США. Будучи менее регламентированным продуктом, биопроизведенная кожа будет легче продвигаться на рынок, спрос будет зависеть от потребительских качеств и цены.
По оценкам специалистов потребности населения в мясе к 2050 году вырастут на 73% к сегодняшнему уровню. Покрыть их планируется не только за счет совершенствования фермерского традиционного производства, но и в основном за счет производства культивированного мяса [15].
Одно из определений: культивированное мясо — это искусственные мышечные протеины (cultured meat — «artificial muscle proteins»). Его можно рассматривать не как окончательный продукт, а как ингредиент для конечного продукта из мяса.
Наиболее важно понять состояние с производством культивированного мяса. Патент на производство тканей мяса для питания человека был получен J. Vein (США) в 1998 г. А первый бургер с культивированным мясом был представлен в 2013 году Maastricht University в Нидерландах. Тема выращивания культивированных продуктов стала очень популярной, и к 2019 году появилось более двух десятков стартапов, занимающихся этой проблемой. Одна из компаний Memphis Meats из Калифорнии объявила о производстве мясных шариков из культивированной говядины, а позже из мяса курицы и утки. При этом цена с 40000 USD/кг при появлении продукта снизилась до 5000 USD/кг через два года и к 2021 цена станет сопоставима с рыночной ценой на традиционное мясо. Несколько компаний в Израиле работают по теме культивированного мяса: компания Super Meats (в кооперации с Hebrew University of Jerusalem), Future Meat Technologies, Meat the Future — вместе они получили на разработку этой проблемы $300 миллионов по соглашению между Китаем и Израилем [16].
В ЕС мясо определяется как «скелетные мышцы с естественным включением жира и соединительной ткани». Структурно мясо может быть образовано из различных тканей, включая скелетные мышцы, кости, соединительные ткани, кровеносные сосуды и нервы (рис. 8).
 Рис. 8. Культивированное мясо
Рис. 8. Культивированное мясо
Преимущественно используют скелетные мышцы с соединительной тканью, которая состоит из коллагена. Существуют три пути формирования скелетных мышц: эмбриональный миогенез, миогенез взрослых и регенерация мышц после травмы. При создании скелетной мышечной ткани используют имитацию регенерации мышц после травмы и/или эмбрионального миогенеза. Хотя тип клеток и пути созревания могут различаться, конечной целью является получение терминально дифференцированной клетки, способной пролиферировать и дифференцироваться в мышечные волокна. Как только мышца созрела, эти мышечные стволовые клетки (сателлитные клетки), превращаются в миоциты, строительные блоки новой взрослой мышцы. При травме восстановление и регенерация мышц происходит в три этапа: воспалительный ответ; активация, пролиферация, дифференцировка и слияние сателлитных клеток; созревание и ремоделирование новых мышечных волокон.
Исходные клетки можно получать разными путями:
— первичные клетки, выделенные из исходной ткани;
— генная инженерия или химический способ с программированием клеток на бесконечное размножение;
— отбор спонтанных мутаций клеток;
— преобразование соматических клеток в плюрипотентные стволовые клетки (iPSC);
— культуры тканей человека (здесь имеется масса этических, медицинских и регулирующих проблем).
Как правило, рассматривается выращивание миоцитов (мышечных клеток) путем регенерации. Тонкие выращенные трехмерные структуры могут использоваться для формирования изделий из обработанного мяса (бургеры, колбасы). Для производства мяса туш и, соответственно, для получения стейка, требуется сложная система с несколькими типами клеток, с оптимизацией выращенных толстых структур с сосудистой системой для обеспечения питательными веществами и кислородом и удалением отходов деятельности клеток. Это долгосрочная программа. Для производства толстых тканей мяса необходимо печатать каркасы из деградирующего материала (например, коллагена), чтобы создать сосудистую систему для поддержания культуры в течение срока роста ткани. Другая проблема — создание крупных биореакторов (объемом более 5000 л) для выращивания больших количеств мышечных тканей для превращения культивируемого мяса в товар. Теоретически в подходящих условиях, к примеру, всего десять мышечных клеток свиньи могут произвести 50000 тонн мяса за два месяца.
Существует два способа производства продукта — один на основе выращивания клеточных тканей и другой на основе процесса ферментации с участием бактерий, водорослей и дрожжей с использованием генной модификации. Полученные органические молекулы затем используются для биопроизводства животных продуктов — биологических эквивалентов (желатина для мяса, казеина для молока, коллагена для кожи). Этот способ предполагает промышленное производство продуктов в больших объемах.
С учетом того, что культивированное мясо является продуктом питания, а не медицинским продуктом, хотя в обоих случаях применяются одинаковые биотехнологии, требования по сертификации продуктов питания будут не такими жесткими, как для медицинского применения.
Культивированное мясо производится без использования искусственных гормонов, антибиотиков, стероидов, ГМО и других, которые обычно применяются в традиционных технологиях производства мяса и рыбы. Чтобы потребитель принял культивированные продукты, нужно убедить его в том, что они отвечают требованиям безопасности, здорового питания, имеют необходимый набор ингредиентов, обладают правильным вкусом и имеют приемлемые цены.
Религиозные моменты: является ли культивированное мясо кошерным? Однозначно да, если клетки взяты от кошерного животного, а в случае, если использованы клетки некошерного животного, например, свиньи или от живого животного, нет единого мнения. По рекомендации Islamic Fiqh Academy (Саудовская Аравия) культивированное мясо может рассматриваться как вегетарианский продукт типа йогурта или ферментированных сыра и пива.
Другие биопечатные продукты питания можно распределить на три категории:
1) продукты, которые легко напечатать, такие как глазурь для пирога и пюре;
2) традиционные продукты, как рис, фрукты и мясо, включая обработанные продукты, такие как макароны;
3) альтернативные продукты, такие как экстракты насекомых, грибов и водорослей.
В перспективе биотехнологии открывают путь к домашней еде с помощью биопринтеров, которые позволяют потребителям печатать свои блюда, выбирая цвет, форму, вкус и текстуру, которые они предпочитают. Пищевые принтеры могут преодолевать границу между медицинскими и немедицинскими приложениями, реагируя на медицинские потребности от профилей питания до рецептов лекарств.
Напечатанная еда меняет идеологию производства и распределения, снижая затраты на транспорт, упаковку, материалы. Для печати продуктов питания используют 4 типа 3D-печати: экструзионную, лазерное спекание (SLS), печать со связующим, струйную.
Необходимо различать 3D-печать готовых продуктов из исходных компонентов, где принтер играет роль агрегатора, и биопечать, в которой конечный продукт получается из напечатанной ткани, выращенной затем в биореакторе.
Применение напечатанной еды: в армии и в космосе, еда для пожилых людей, сладкие продукты, жевательная резинка.
Новые синтетические биоматериалы — новые возможности
Новые синтетические биоматериалы — это материалы нового поколения с новыми и расширенными функциональными свойствами [17] (рис. 9).
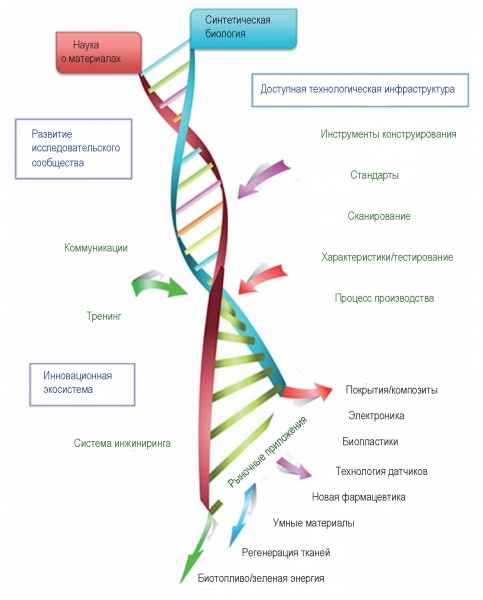
Рис. 9. Новые синтетические материалы
Слияние синтетической биологии и синтетической химии в сочетании с современными производственными платформами, такими как АМ (3D-печать), определяет новую эру в исследовании новых материалов.
Инженерная биология синтетических биологических материалов открывает новые возможности:
1) быстрое увеличение разнообразия материалов,
2) иерархическая сборка новых многокомпонентных, многофункциональных материалов (например, путем объединения платформ синтетической биологии и изготовления материалов, включая производство добавок, прядение, технологии нанесения покрытий),
3) доступные/устойчивые пути производства (например, ферментация на отходах),
4) снижение воздействия на окружающую среду при производстве материалов следующего поколения.
Синтетические биологические материалы могут маркироваться путем записи ДНК и использоваться затем для сборки этих биологических «частей» с другими (например, небиологическими) компонентами, давая возможность собирать новые сложные структуры.
Возможны следующие применения синтетических биологических материалов нового поколения.
В области биоэлектроники могут быть представлены новые конструкции, генетически закодированные в форме окислительно-восстановительных полимеров (белков) или нанопроводов, где преобразование сигнала является встроенной функцией.
Они найдут применение в здравоохранении для раннего обнаружения/мониторинга, быстрого анализа in vivo, в виде интеллектуальных микробиоэлектронных систем (например, затраты на диагностику рака и диабета II типа в США составляют 200 миллиардов долларов на прямые медицинские расходы, а болезнь сердца поражает 22 миллиона граждан США и требует затрат на сумму 172 миллиарда долларов).
Новые материалы в форме покрытий или пористых материалов с улучшенными проводящими свойствами можно применять в разработке аккумуляторных электродов для увеличения емкости и скорости заряда/разряда или аккумуляторных батарей для мобильных электронных устройств. Синтетическая биология может быть использована для создания устройств связи между электронными приборами и биологическими системами [18]. В электронной промышленности изготовление нанопроводников с использованием пептидных каркасов позволит создавать шаблоны для металлизации [19].
Внеклеточные пути переноса электронов, с помощью которых бактерии электрически связываются между своими внутриклеточными запасами химической энергии и внеклеточными твердыми веществами, также представляют потенциальные возможности применения в биокомпьютерах, биоэнергетике и биосенсорах [20]. Синтетические биологические материалы для оптики, способные управлять распространением света (например, структурный цвет, антиотражение, фокусировка света и т. д.) [21], являются основой для проектирования новых микроструктур для интеллектуальных оптических устройств, для оптических датчиков, для преобразования световой энергии.
В природе присутствует огромный спектр материалов с нужными нам свойствами прочности, гибкости, адгезии, прозрачности, отражательной способности, проводимости и т. д. Задача исследователей — обеспечить разработку новых материалов с улучшенной функциональностью на основе понимания взаимодействия между неорганическими фазами (соли или оксиды) и биомолекулами (белками, липидами, углеводами или полиамидами). Примером разработки композитного материала с заданными свойствами является искусственный перламутр, в котором крошечные арагонитовые плитки удерживаются вместе за счет синтетических структур, которые имитируют структурные и механические характеристики их естественных аналогов и были созданы с помощью предварительно разработанной матрично-направленной минерализации [22].
Существует растущий интерес к разработке интеллектуальных материалов (например, многофазных систем или мембран) с интегрированными биологическими функциями и к существующим материалам, которым нужно придать необходимую функциональность. Последняя обладает возможностью «умных» материалов, способных самостоятельно собираться, самовосстанавливаться или развиваться. Эти материалы найдут применение в здравоохранении (например, персонализированные лекарства).
Другой пример — это использование генетически изменяемых микробных клеток для создания многофункциональных чувствительных интерфейсов (например, к влаге), где добавляются новые функциональные возможности (типа свечения, цвета или запаха).
Самовосстанавливающиеся материалы имеют встроенную способность автоматически восстанавливать появляющиеся повреждения без внешней диагностики проблем или вмешательства человека. Задача состоит в том, чтобы создать автономные адаптивные структуры (термопластики) или самовосстанавливающиеся полимерные материалы, которые используют ион-дипольные взаимодействия. Так, полученные материалы могут растягиваться в 50 раз по сравнению с их обычными размерами и после разрыва на две части могут самостоятельно восстанавливаться в течение одного дня. Электропроводные самовосстанавливающиеся материалы найдут применение в сенсорных экранах.
Синтетические биологические материалы открывают новые возможности для разработки микромеханических устройств. Например, биоинженерия для биомолекулярного управления (с использованием ДНК, РНК и других биомолекул для движения) при создании чувствительных структур и поведенческих материалов с функциями расширения или движения для биомолекулярных программируемых роботов.
Искусственные мышцы для исполнительных элементов роботов можно создать на основе спиральных катушек из ориентированных полимерных волокон, которые генерируют большие обратимые изменения длины в результате теплового расширения при геометрическом ограничении (наматывание/разматывание спиральных конструкций) [23]. Это обеспечивает движение посредством процессов, связанных с внутренними изменениями в составляющих материалах, и может стать альтернативой существующим механическим приводам современных роботов.
Для тканевой инженерии чувствительные полимеры позволяют строить каркасы, чувствительные к различным физиологическим стимулам (например, pH, температуре и концентрации соли). Синтетическая биология также предлагает технологию включения стабильных изотопов (например, дейтерия), которые в твердых материалах могут привести к улучшению физических и функциональных свойств. Одно из направлений синтетической биологии — создание библиотек молекулярных мономеров для получения строительных блоков разного назначения, в основном для построения полимерных каркасов. Другое направление — биополимерные строительные блоки для биоэлектроники и разработки оптических свойств. Это будут белковые модули, разработанные для взаимодействия с другими компонентами (каркасами, поверхностями и другими сделанными на заказ молекулами), которые, например, передают электрические, оптические, флюоресцентные сигналы.
Создание материалов более высокого порядка с новыми свойствами потребует дальнейшей разработки инструментальных платформ, таких как технологии прядения и сопряжения с 2D/ 3D-печатью, сборка слоистых материалов с помощью аддитивного производства и самостоятельная сборка новых и разнообразных компонентов. Также необходимо иметь измерительные системы для оценки физических свойств биоматериалов, таких как: реология, испытания на растяжение, узконаправленное или широкоугольное рентгеновское рассеяние, рассеяние света, тепловые характеристики и структурный анализ с помощью набора методов визуализации и спектроскопии. Широкое применение синтетических биоматериалов потребует создания производственной базы, рассчитанной на выпуск больших объемов недорогих материалов.
Создание бинарных (или более высокого порядка) материалов, где нужные свойства появляются только при смешивании или сборке компонентов, является важным фактором для быстрого проектирования новых материалов. Это потребует использования всех синтетических методологий, включая химический, биологический и нанотехнологический подходы, а также использования аддитивного производства — области, охватывающей проектирование, изготовление, сборку и измерение биоэлементов для доставки конструкций, устройств и систем и их последующего использования in vivo или in vitro в более масштабных структурах.
Огромное разнообразие новых синтетических биоматериалов с широким спектром характеристик потребует диверсификации за счет генетического кодирования неканонических аминокислот на платформах синтетической биологии. Метки могут быть сохранены, расщеплены и даже размещены в различных точках кодирующей последовательности ДНК и будут легко считываться.
К характеристикам новых биоматериалов следует отнести структурные (размер, прочность, гибкость, форма и т. д.), функциональные (проводимость, программируемость, чувствительность к свету, вязкость, эластичность и т. д.), биологическая и химическая стабильность, способность к самосборке, анизотропия поведения, биосовместимость, токсичность. Потребуется мощное программное оснащение с соответствующими базами данных, позволяющее быстро находить и анализировать имеющиеся отдельные строительные блоки биоматериалов, возможность их использования для получения материалов высокого уровня с заданными свойствами.
Инновации в области синтетических биологических материалов должны охватывать весь цикл от открытия, разработки, тестирования и изготовления новых современных материалов до индустриализации и коммерциализации. Необходимо использовать доступные инструменты и инфраструктуры, имеющиеся сегодня в смежных областях синтетической биологии (например, в производстве биохимических веществ).
Социальные, этические, культурные, экономические и экологические аспекты биопроизводства [24]
3D-биопечать приводит к децентрализации производства с акцентом в сторону малых предприятий в силу ряда привлекательных опций: невысокой стоимости, кастомизации, быстрого производства, расположения рядом с потребителем.
Возможные социальные направления применения:
— косметическая хирургия для улучшения тела, объемное представление постоперационного тела, боди-арт (художник Diemut Strebe): напечатанное ухо V. van Gogh [25] с использованием живых клеток потомка художника, Lieuwe van Gogh имеет 1/16 часть набора генов своего знаменитого предка. Произведение было представлено в ZKM Media Museum в Германии. Ухо построено из живых клеток и может оставаться биологически «живым», пока его поддерживает биораствор, в котором оно находится. «Вы можете поговорить с ухом» (рис. 10 а, б).

а) б)
Рис. 10. Vincent van Gogh (а) и напечатанное ухо (б)
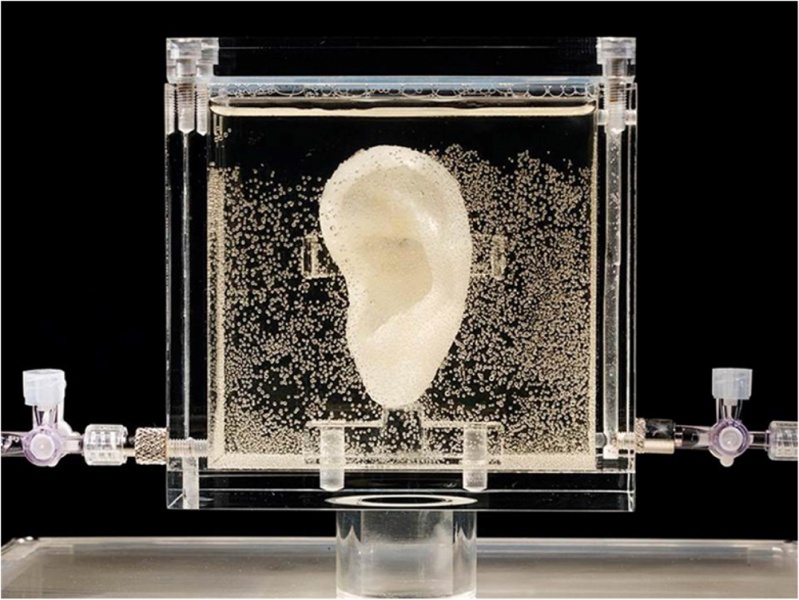
Другой пример — выращенное на биопринтере из хряща клиента — современного художника ухо, пересаженное на его руку (рис. 11).
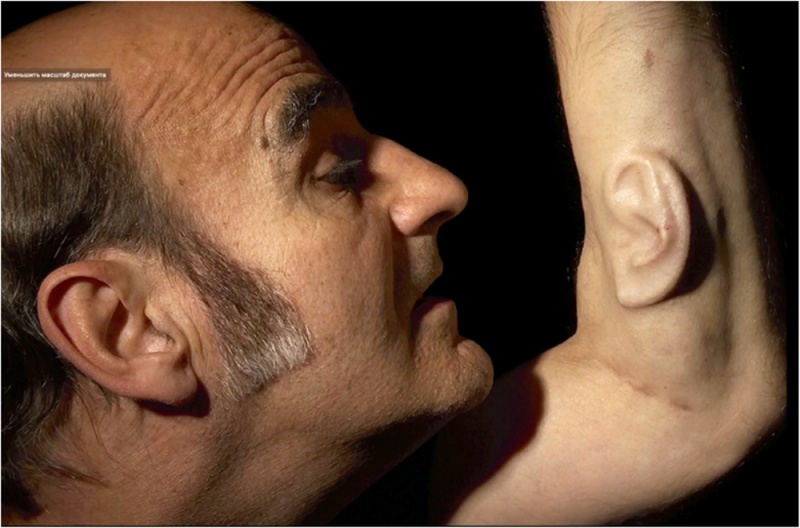 Рис. 11. Напечатанное и пересаженное на руку клиента ухо
Рис. 11. Напечатанное и пересаженное на руку клиента ухо
Децентрализация производства с 3D-печатью позволит пациентам получать выгоду от более персонализированного лечения с меньшим количеством посещений больницы и сокращением времени ожидания, поскольку медицинские продукты и услуги могут оказываться в рамках существующей лабораторной инфраструктуры.
3D-печать также ассоциируется с «демократизацией» производства, т. е. возможно появление так называемых «3D-биохакеров», то есть биологов-самоучек, использующих 3D-принтеры для экспериментов вне обычных научных, медицинских и коммерческих учреждений.
Другая угроза в использовании АМ в производстве наркотиков и гастрономии.
Культурные аспекты
Рассматриваются три возможных сценария развития АМ в биологии и соответствующего влияния на человечество:
1. Ящик Пандоры — 3D-биопечать непреднамеренно создает серьезные угрозы для общества.
2. Рог изобилия — представляет его как поставщика практически неограниченных ценных ресурсов.
3. Волшебный мешок — изображает технологию как таинственный элемент, который преподносится как подарок или награда, но обладает способностью скрывать или обманывать.
Понимание этих сценариев может стимулировать осторожный подход к развитию технологий и, в частности, задуматься о наших взаимоотношениях с собственными телами, поскольку границы между естественными и изготовленными частями тела могут быть размыты.
Социальные аспекты
Ключевым аспектом для медицинских изделий является обеспечение доступности новых методов лечения для граждан. Нужно гарантировать, что развивающиеся страны смогут воспользоваться новейшими разработками в области 3D-биопечати для пациентов с ограниченными возможностями.
Другим важным аспектом является влияние биотехнологий на занятость. В случае 3D-биопечати использование инфраструктуры 3D-печати в медицинском секторе может повлиять на инфраструктуру и деятельность лаборантов.
Этические аспекты
К ним относятся вопросы безопасности, охраны, донорства органов, защиты данных и прав интеллектуальной собственности. С безопасностью в первую очередь связаны возможные использования для создания биологического оружия и других видов биологической опасности, в частности, в случае генной инженерии «своими руками» или производства опасных материалов вне контролируемой среды.
Одна интересная будущая возможность заключается в снижении потребности в экспериментах на животных, поскольку соответствующие биоматериалы могут быть изготовлены в лаборатории. Однако эксперименты на животных будут необходимы в медицинских исследованиях.
Экономические и экологические аспекты
Оценки потенциальных экономических последствий 3D-печати в целом положительные, но значительно различаются.
Проблемы и варианты:
1. Нормативная база (нормативные последствия классификации продуктов (например, как медицинских или терапевтических, как биологических или небиологических); защита данных, интеллектуальной собственности и конфиденциальности; вопросы безопасности и информированного согласия; стандартов).
2. Справедливое распределение выгод.
3. Роль граждан в формировании развития.
Проблемы и варианты, связанные с нормативными подходами
Первая нормативная проблема заключается в определении и классификации процессов и продуктов, связанных с 3D-биопечатью. Некоторые 3D-биопечатные изделия будут сочетать биологические и небиологические компоненты и могут не соответствовать определению, например, медицинские устройства или передовые методы лечения. Различные правила применяются к биологическим и небиологическим материалам (например, для каждого из которых требуется отдельная лицензия), что приводит к осложнениям для комбинированных продуктов, таких как 3D-печатные каркасы, на которых выращиваются живые клетки. Точно так же, хотя медицинские приборы имеют более строгие стандарты и более высокие барьеры для одобрения на рынке, чем немедицинские устройства, стандарты и барьеры для передовых методов лечения еще сильнее и выше. Разработчики и инноваторы в этой области должны получить четкое руководство по определению и классификации своей продукции, чтобы понимать, какие правила, стандарты и процедуры к ним применяются.
Вторая нормативная проблема заключается в защите данных, интеллектуальной собственности и конфиденциальности. Например, децентрализованная сеть служб трехмерной визуализации и биопечати, которые предоставляют специализированные медицинские устройства, может иметь доступ к конфиденциальным медицинским данным и другой личной информации. Достижения в области 3D-биопечати могут привести к возникновению вопросов о владении устройствами и биоматериалами, имплантированными в тела пациента, а также о патентоспособности новых биологических материалов, которые существенно отличаются от «натуральных» биоматериалов.
Третья нормативная проблема связана с безопасностью, в частности, с рисками выполнения процедур и осуществления производства продукции вне профессиональной среды, с соблюдением этических стандартов, таких как информированное согласие. Также эти проблемы безопасности должны быть сбалансированы с потенциальными выгодами демократизации технологий. Например, 3D-биопечать своими руками может способствовать инновациям с хорошими социальными результатами и может привлечь новое поколение граждан, стремящихся узнать о науке, технике, производстве и медицине.
Четвертая нормативная проблема заключается в тестировании и стандартах на продукцию. Там, где это разрешено оптимизацией результатов и безопасности пациентов, тестирование и стандарты могут фокусироваться на процессе 3D-биопечати и широких параметрах ее продуктов, а не на конкретных продуктах.
Решение этих проблем требует баланса в подходе к регулированию, например, для обеспечения высоких стандартов для медицинских продуктов без блокирования выгодных инноваций на рынке.
Проблемы и варианты, связанные с распределением выгод
Социальная справедливость и распределение выгод могут быть сформулированы как проблема регулирования среди различных социальных групп: стоимость и доступность для граждан.
В ходе исследования были определены два широких варианта: ориентированная на миссию и открытая политика в области инноваций.
Ориентированная на миссию политика направлена на достижение конкретных результатов и может способствовать разработке 3D-биопечати для решения конкретных медицинских проблем.
Политика открытых инноваций направлена на создание условий, в целом благоприятных для новых разработок в широком спектре областей. Такая политика может быть направлена на поощрение более широкого круга участников — включая университеты, компании и сообщества — работать вместе и обмениваться данными, результатами и решениями.
Заключительные замечания
Три ключевые тенденции: децентрализация, индивидуальная деятельность и массовая кастомизация тесно связаны с 3D-печатью и биопечатью и могут оказать существенное разрушительное влияние на общество.
Основные узлы, обеспечивающие широкую сеть пользователей, могут постепенно заменяться большим количеством собственных производств и услуг. Это достигается за счет снижения накладных расходов и снижения требований к экспертным знаниям, а также благодаря требованию получать больше товаров и услуг по индивидуальному заказу. Однако для медицинских применений эта тенденция может быть менее выраженной, поскольку более высокие стандарты для медицинских изделий и устройств требуют жестко контролируемых инфраструктур производства и тестирования, что предполагает более высокие накладные расходы и большую зависимость от опыта специалистов. Таким образом, хотя возможна некоторая степень децентрализации, центральная структура вряд ли полностью исчезнет.
Направление, связанное с 3D-печатью, приводит к появлению частников и сообществ «мастеров по оказанию услуг», то есть к выходу за рамки профессиональной лабораторной среды. Эта деятельность может осуществляться в немедицинских целях, возможно, по коммерческим, художественным или эстетическим причинам или просто как хобби.
Переход к «массовой кастомизации» — полуавтоматизированному производству персонализированных изделий в больших масштабах — это одно из ключевых преимуществ АМ, потому что она может позволить более дешевое, более автоматизированное производство сделанных на заказ продуктов, которые действительно предназначены для тела отдельных пациентов. И здесь нужно будет найти альтернативные способы поддержания таких же высоких стандартов качества в рамках парадигмы массового производства, например, смещая фокус испытаний с самих продуктов на процессы и материалы, которые используются для их изготовления.
Неоднозначная граница между выздоровлением и улучшением состояния человека
Разработка однозначной границы между медицинскими и немедицинскими процедурами потребует четкого определения нормальности. Достижение этой точки для компенсации какой-либо инвалидности или болезни будет рассматриваться как выздоровление, а выход за пределы этого для дальнейшего улучшения способностей будет улучшением. Однако такие понятия, как нормальность и инвалидность, являются относительными, гибкими и чувствительными к контексту. Как таковые некоторые вмешательства могут рассматриваться как медицинские в одном контексте и как косметические — в другом контексте. Эта граница, вероятно, будет оставаться неоднозначной в течение некоторого времени, но может иметь важные юридические и социальные последствия, важно постоянно контролировать эту границу.
Ответственные исследования и инновации
Планируется, что в рамках европейского текущего проекта SMART-Map, финансируемого Horizon2020, будут разработаны конкретные дорожные карты для ответственного развития технологий 3D-печати и услуг в области биомедицины.
Ответственные исследования и инновации (RRI) — это плюралистический подход к управлению инновациями, который все больше интегрируется в инициативы ЕС в области исследований и инноваций. Он часто используется в качестве основы для разработки значимых мероприятий по взаимодействию с общественностью и заинтересованными сторонами.
Степень неопределенности и широкомасштабные воздействия 3D-биопечати оправдывают серьезные коллективные размышления о направлении ее развития, и RRI может помочь структурировать дискуссию.
Управление ожиданиями
Технологии являются социальными, и социальные ценности меняются со временем. Этические, социальные и культурные силы могут влиять на будущее направление развития 3D-биопечати так же, как и на технические разработки. Они также могут привести к изменениям в нашем понимании и ожиданиях технологии. Поэтому важно постоянно размышлять о границах приемлемости различных приложений.
Хотя возможно активное изменение социальных установок, гораздо сложнее убедить людей принять непопулярные технологии, чем найти пути обеспечения того, чтобы технологии развивались так, чтобы это было приемлемо для людей. В этом отношении могут помочь выводы из социальных исследований науки и техники, включая ответственные исследования и инновации.
Заключение
Бизнес в области моделирования моделей тканей/органов можно рассматривать как многоступенчатый процесс. Учитывая, что эти модели в настоящее время предназначены главным образом для исследовательских целей, они не обязаны проходить высокий уровень сертификации и/или нормативного контроля. В конечном счете, однако, ожидается, что эта технология станет важным инструментом в диагностической и персонализированной медицине, а также в качестве надежных платформ для скрининга лекарственных средств (в качестве альтернативы испытаниям на животных), где регуляторный контроль является чрезвычайно требовательным. Многие модели тканей/органов на основе биопроизводства в настоящее время разрабатываются различными организациями (академическими и неакадемическими), что отражает высокий спрос на исследования.
Производство культивированного мяса в глобальном масштабе способно привести к изменению климата на Земле из-за перестройки структуры сельского хозяйства. Понятно, что на это потребуются десятки лет, и даже появление на рынке культивированного мяса в виде переработанных продуктов (бургеров и колбас) не произойдет в ближайшие несколько лет.
В целом биотехнология находится на правильном пути к коммерциализации, но все еще на довольно ранней стадии. Ожидается, что в ближайшие несколько лет ее развитие ускорится, что приведет к увеличению доступности продуктов на основе биотехнологий на рынке. ■
Литература
- Chimene, D.; Lennox, K.K.; Kaunas, R.R.; Gaharwar, A. K. Advanced bioinks for 3D printing: A materials science perspective. Ann. Biomed. Eng. 2016, 44, 2090.
- Bose, S.; Vahabzadeh, S.; Bandyopadhyay, A. Bone tissue engineering using 3D printing. Mater. Today 2013, 16, 496–504.
- Sun, J.; Vijayavenkataraman, S.; Liu, H. An overview of scaffold design and fabrication technology for engineered knee meniscus. Materials 2017, 10, 29.
- Qi X, Wang H, Zhang Y et al. Mesoporous bioactive glass-coated 3D printed borosilicate bioactive glass scaffolds for improving repair of bone defects. Int. J. Biol. Sci. 14 (4), 471 (2018).
- Touri M, Moztarzadeh F, Osman NaA, Dehghan MM, Mozafari M. Optimisation and biological activities of bioceramic robocast scaffolds provided with an oxygen-releasing coating for bone tissue engineering applications. Ceram. Int. 45 (1), 805–816 (2019).
- Zhou X, Zhu W, Nowicki M et al. 3D bioprinting a cell-laden bone matrix for breast cancer metastasis study. ACS Appl. Mater. Interfaces 8, 30017–30026 (2016).
- Bioactive scaffolds for osteochondral regeneration. Cuijun Deng, Jiang Chang, Chengtie Wu. Journal of Orthopaedic Translation Volume 17, April 2019, Pages 15–25.
- C. Deng, Q. Yang, X. Sun, L. Chen, C. Feng, J. Chang, et al. Bioactive scaffolds with Li and Si ions-synergistic effects for osteochondral defects regeneration. Appl Mater Today, 10 (2018), pp. 203–216.
- Wei, Y.; Li-Tsang, C.W.; Liu, J.; Xie, L.; Yue, S. 3D-printed transparent facemasks in the treatment of facial hypertrophic scars of young children with burns. Burns 2017, 43, e19–e26.
- The application of 3D-printed transparent facemask for facial scar management and its biomechanical rationale. Wei Y, Wang Y, Zhang M, Yan G, Wu S, Liu W, Ji G, Li-Tsang CWP. www.ncbi.nlm.nih.gov/pubmed/29032976
- John Kosowatz Biotechnology Anticipates 4D Printing, ASME, Apr 1, 2020
- www.bioprinting.ru
- J. M. Utterback, W. J. Abernathy A dynamic model of process and product innovation. Omega, 3 (1975), pp. 639–656.
- Translating Biofabrication to the Market. Pedro F. Cost Trends in Biotechnology. Volume 37, Issue 10, October 2019, Pages 1032–1036
- Consumer acceptance of cultured meat: A systematic review Christopher Bryant*, Julie Barnett. Meat Science 143 (2018) 8–17.
- Bringing cultured meat to market: Technical, socio- political, and regulatory challenges in cellular agriculture. Neil Stephens, Lucy Di Silvio, Illtud Dunsford, Marianne Ellis, Abigail Glencross, Alexandra Sexton. Trends in Food Science & Technology Volume 78, August 2018, Pages 155–166.
- A living foundry for Synthetic Biological Materials: A synthetic biology roadmap to new advanced materials Rosalind A. Le Feuvre, Nigel S. Scrutton. Synthetic and Systems Biotechnology Volume 3, Issue 2, June 2018, Pages 105–112.
- T. Tschirhart, E. Kim, R. McKay, H. Ueda, H. C. Wu, A. E. Pottash, A. Zargar, A. Negrete, J. Shiloach, G. F. Payne, W. E. Bentley Electronic control of gene expression and cell behaviour in Escherichia coli through redox signaling. Nat Commun, 8 (2017), p. 14030.
- L. Wu, J. He, W. Shang, T. Deng, J. Gu, H. Su, Q. Liu, W. Zhang, D. Zhang. Optical functional materials inspired by biology. Adv. Optical Mater, 4 (2016), pp. 195–224.
- M.A. TerAvest, C. M. Ajo-Franklin Transforming exoelectrogens for biotechnology using synthetic biology. Biotechnol Bioeng, 4 (2015), pp. 687–697.
- K. H. Chan, W. H. Lee, S. Zhuo, M. Ni Harnessing supramolecular peptide nanotechnology in biomedical applications. Int J Nanomed, 12 (2017), pp. 1171–1182.
- L. — B. Mao, H. — L. Gao, H. — B. Yao, H. Cölfen, G. Liu, S. — M. Chen, S. — K. Li, et al. Synthetic nacre by predesigned matrix-directed mineralization. Science, 354 (2016), pp. 107–110
- C. S. Haines, N. Li, G. M. Spinks, A. E. Aliev, J. Di, R. H. Baughman New twist on artificial muscles. Proc Natl Acad Sci, 113 (2016), pp. 11709–11716.
- Philip Boucher, July 2018 Scientific Foresight Unit (STOA) PE 614.571.
- https://3dprint.com/5165/vincent-van-gogh-3d-printed-ear/
Автор: Николай Михайлович Максимов
Источник журнал "Аддитивные технологии" № 4-2020



