Термины и определения [1]
Биопроизводство — это процесс генерации биологических структур, обладающих сложной архитектурой, с использованием высокопроизводительных методов, таких как 3D-биопечать, биореакторы, и материалов на основе так называемых биочернил.
Биопечать предполагает процедуру фазового перехода из жидкого состояния в твердое при послойной печати или из твердого в гелеобразное. Биочернила являются биосовместимыми или инертными и могут содержать специальные активные биологические компоненты, такие как тканевые сфероиды, клеточные суспензии и биоактивные агенты. Биочернила могут наноситься непосредственно сразу на подготовленный построенный каркас, но чаще всего они вносятся на более поздних стадиях.
Биореакторы — это автоматические системы, которые позволяют эффективно и точно воспроизводить, размножать и дифференцировать клетки в контролируемой среде (in vitro).
3D-биопечать можно рассматривать как одно из важнейших приложений АМ-технологий в медицине, а именно — в биомедицине. Биотехнология является основой для тканевой инженерии (производство живых тканей) и регенеративной медицины (TERM, рис. 1), а также для таких приложений, как открытие/разработка лекарств, в частности индивидуальное дозирование лекарств; изучение микросреды рака; решение проблемы с анатомическими животными; производство продуктов питания: мяса и кожи.
![а) дефект черепа, имплантат и результат операции [2]; b) анизотропная сердечная ткань на гибкой подложке с датчиками, выращенная с использованием биотехнологии [3]; c) нефрологическая модель [4]; d)типы биотехнологических инноваций [5]; e) этапы инноваций в биологии (Utterback и Abernathy) [6]](/sites/default/files/Images/Public/statia_primenenie_am_v_bioprintenge_ris1_at_2_2020.jpg)
Рис. 1. Примеры регенеративной медицины: а) дефект черепа, имплантат и результат операции [2]; b) анизотропная сердечная ткань на гибкой подложке с датчиками, выращенная с использованием биотехнологии [3]; c) нефрологическая модель [4]; d)типы биотехнологических инноваций [5]; e) этапы инноваций в биологии (Utterback и Abernathy) [6]
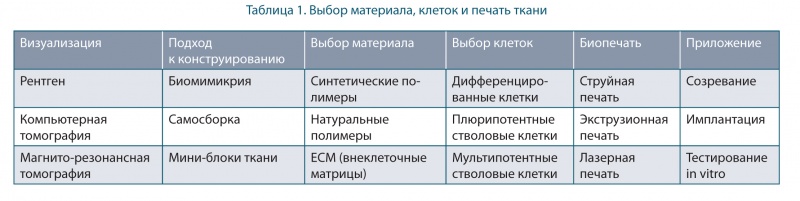
Основные подходы в биопроизводстве:
Биомимикрия — аналог природным структурам, с использованием биочернил, предполагает создание идентичных клеточных и внеклеточных компонентов тканей, их размножение в микромасштабе. Компоненты, необходимые для 3D-биопечати тканей, приведены на рис. 2 [5].

Рис. 2. Схема биопечати
Автономная самостоятельная сборка — аналог физическим процессам при развитии эмбрионального органа, с использованием сфероидов. Ранние клетки, которые вырабатываются во время развития тканей, производят свои собственные компоненты ECM, организуют передачу сигналов и шаблонов клеток, которые дают желаемую биологическую функцию [6, 7, 8].
Тканевые строительные мини-блоки. Данная концепция связана с обеими вышеупомянутыми стратегиями. Наименьшие структурные и функциональные строительные мини-блоки, как нефрон в почке, например, образуют органы и ткани. Они объединяются между собой путем самосборки, чтобы сформировать сложную трехмерную конструкцию с законченными структурными, функциональными и механическими свойствами.
Обычно различают два направления 3D-печати в медицине: с применением полимеров для моделирования частей тела или для создания имплантатов, и биопечать, которая использует клетки для создания органического материала. С производством реальных человеческих тканей, реплик органов и функциональных структур органов биопечать может стать дополнением к традиционным трансплантациям донорских органов, а затем и практически заместить их.
Основными этапами биопечати являются визуализация, дизайн, выбор материала, отбор клеток и печать конструкции ткани [9], приведенные в таблице 1.
Биочернила
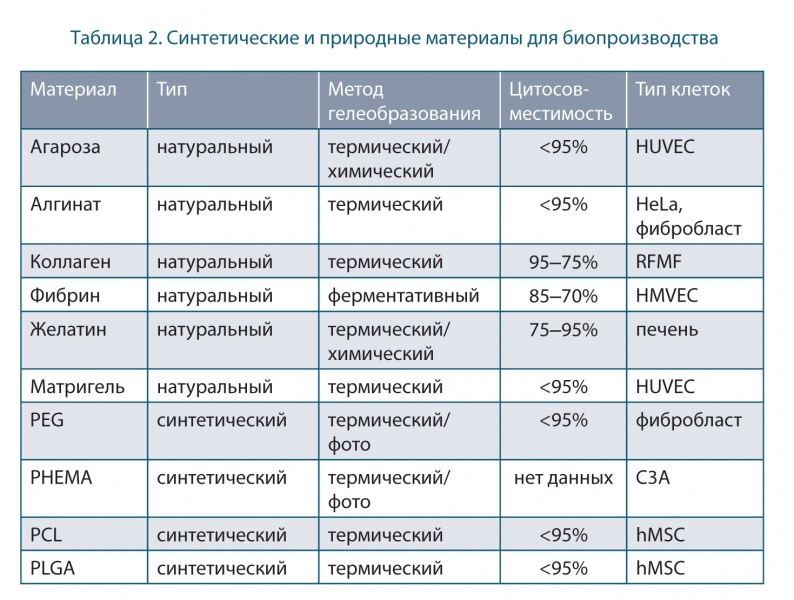
Биочернила представляют собой жидкий раствор, содержащий тканевые сфероиды или клеточные суспензии. В 3D-биопечати наиболее широко используются органические растворы (альгинатные гидрогели, коллаген и гиалуроновая кислота), синтетические биоматериалы (PCL и другие) для механической поддержки клеточных тканевых конструктов или их смеси. Наиболее перспективны наноцеллюлозные материалы благодаря высокому содержанию в них воды, хорошей механической прочности и свойствам разжижения при сдвиге (рис. 3).
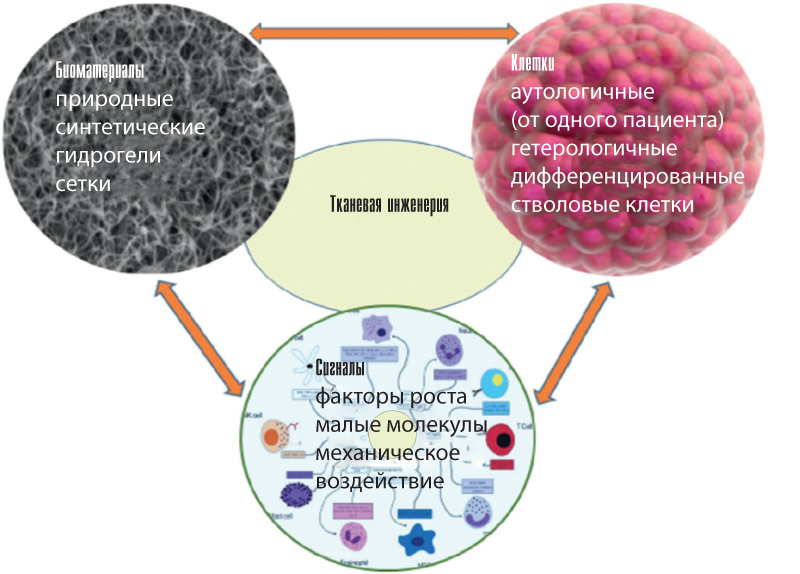
Рис. 3. Составляющие для тканевой инженерии
Биочернила должны обладать такими характеристиками, как пригодность для печати, высокие механические свойства, биодеградация в контролируемой среде и нетоксичность для клеток [5].
Биочернила на основе природных полимеров
Гидрогели включают в себя живые клетки, а также стимуляторы, которые определяют различные формы их поведения, такие как миграция, пролиферация, дифференцировка и созревание. Основной недостаток природных гидрогелей — это изменчивость от партии к партии.
Альгинат — обладает идеальной биосовместимостью и обеспечивает простое и быстрое гелеобразование.
Коллаген — является частью различного внеклеточного матрикса (ECM) и участвует в физиологических взаимодействиях между клетками и ECM. Простое сшивание посредством термореактивного гелеобразования в физиологических условиях является основным преимуществом биочернил на основе коллагена.
Желатин — это форма коллагена, которая денатурируется и находит применение в пищевой, фармацевтической и косметической промышленности в качестве гелеобразующего агента.
Фибрин состоит из продуктов взаимодействия фибриногена и тромбина и действует как хирургический клей в процессе заживления ран благодаря своей способности к быстрому гелеобразованию.
Биочернила на основе синтетических и полусинтетических материалов
Материалы PCL, PEG, PLGA, PLA и PGA в основном используются в тканевой инженерии из-за их высокой механической прочности. Например, PCL может использоваться для ортопедических приложений при остеоинтеграции костных тканей. Синтетические и натуральные материалы, используемые в биотехнологии, приведены в таблице 2 [10].
В процессе биопроизводства биочернила превращаются в трехмерную конструкцию, последовательно фиксируемую гелеобразованием — физико-химическим процессом сшивания, которое основано на сетках избыточных цепей молекулярных полимеров, ионных взаимодействиях и водородных мостиках [11]. Этот тип сшивки совместим с живыми клетками, но имеет недостаточные механические свойства. Для преодоления этого недостатка используются дополнительные сшивающие материалы.
Вязкость гидрогеля является другим важным аспектом биопечати. Повышенная концентрация полимера приводит к жесткости геля, что сводит к минимуму подвижность клеток в водной среде.
Возможное решение для трансплантации органов состоит в том, чтобы восстановить собственные органы человека, что делается с помощью тканевой инженерии. При традиционном подходе к тканевой инженерии выделяют небольшой образец ткани пациента, извлекают стволовые клетки, смешивают с факторами роста и дают возможность культивировать в лаборатории, помещая их на опору, называемую каркасом, из которого регенерируется весь орган. Трехмерная биопечать обеспечивает дополнительное существенное преимущество по сравнению с традиционной тканевой инженерией, так как имеет высокий контроль над концентрацией, объемом, диаметром и разрешением печатаемых клеток и производит их либо слой за слоем, либо непосредственно в конечную трехмерную подобную ткани структуру.
Сначала клетки выращиваются как монослой, потом высеваются в специально построенные каркасы в биореакторе, где они могут размножаться. Каркасы должны быть разлагаемыми. Клетки можно выращивать как в биореакторе, так и в донорском теле. Следующим шагом (4D-биопечать) должно стать выращивание сигнальных систем, как, например, для сердца и мозга. Тонкие ткани (до 400 мкм), размещенные в донорском теле, обеспечиваются всем необходимым для жизнедеятельности клеток. Для тканей больших размеров необходима сосудистая структура.
Плюрипотентные стволовые клетки (pluripotent stem cells), или мастер-клетки [12].
Плюрипотентные стволовые клетки способны производить любые клетки или ткани, дифференцироваться или созревать в три основные группы клеток, которые формируют человека:
— эктодерма — создает кожу и нервную систему;
— эндодерма — формирует желудочно-кишечный тракт и дыхательные пути, а также железы внутренней секреции, печень и поджелудочную железу;
— мезодерма — формирует кость, хрящ, большую часть кровеносной системы, мышцы, соединительную ткань и многое другое.
Это их основное свойство называется плюрипотентностью.
Типы плюрипотентных стволовых клеток
Индуцированные плюрипотентные клетки (iPS). Можно взять обычную клетку, такую как клетка кожи, и «перепрограммировать» ее, вводя несколько генов, которые превращают ее в индуцированную плюрипотентную клетку (iPS). Лаборатория в Детской больнице Бостона была одной из первых, сделавших это открытие, а журнал Science обозначил его как прорыв года в 2008 году. iPS-клетки обладают огромным терапевтическим потенциалом. Поскольку они происходят из собственных клеток пациента, они генетически соответствуют этому пациенту и могут устранить проблемы с подбором и отторжением тканей, которые в настоящее время препятствуют успешной трансплантации клеток и тканей. iPS-клетки также являются ценным исследовательским инструментом для понимания развития различных заболеваний.
Эмбриональные стволовые клетки. Ученые используют термин «эмбриональные стволовые клетки» в качестве общего термина для плюрипотентных стволовых клеток, которые получены с использованием эмбрионов или яиц, а не для клеток, генетически перепрограммированных из организма. Существует несколько типов эмбриональных стволовых клеток:
1. «Истинные» эмбриональные стволовые клетки (ES) получают из неиспользованных эмбрионов, которые были пожертвованы парами, которые подверглись экстракорпоральному оплодотворению (ЭКО). Они являются «общими» и генетически не соответствуют конкретному пациенту, поэтому вряд ли будут использоваться для создания клеток для лечения, скорее, для научных исследований.
2. Стволовые клетки, полученные путем переноса ядер соматических клеток (nTES). Термин перенос ядра соматической клетки (SCNT) означает буквально передачу ядра (которое содержит все генетические инструкции клетки) из соматической клетки — любой клетки организма — в другую клетку, в данном случае яйцеклетку. Этот тип клеток был успешно получен только у низших животных. Чтобы получить клетки nTES у пациентов‑людей, требуется донор яйцеклетки, а также клетка пациента (обычно клетки кожи).
3. Стволовые клетки из неоплодотворенных яйцеклеток pES (партеногенетические эмбриональные стволовые клетки). Посредством химической обработки неоплодотворенные яйцеклетки могут быть «обмануты» для пре-вращения в эмбрионы без оплодотворения спермой — процесс, называемый партеногенезом. Если этот метод окажется безопасным, женщина сможет пожертвовать свои собственные яйцеклетки, чтобы создать плюрипотентные стволовые клетки, генетически соответствующие ей, которые, в свою очередь, могут быть использованы для создания клеток, которые не будут отторгнуты ее иммунной системой. Поскольку клетки pES могут быть получены более легко и более эффективно, чем клетки nTES, они потенциально могут быть готовы к клиническому использованию раньше.
Обзор методов биопечати
Из 7 групп АМ-технологий (стандарт F2792 [1–5] ASTM) наибольшее распространение в биопроизводстве получили технологии (рис. 4):
а) лазерная — лазерные импульсы создают высокое давление на донорской пластине, покрытой гидрогелем с клеточным материалом, что побуждает частицы гидрогеля переходить на рабочую пластину;
б) струйная (InkJet, термическая и пьезоэлектрическая) — частицы биополимера или гидрогеля с клеточным материалом инжектируются в виде капель через сопло, либо за счет образования паровых пузырей при электрическом нагреве, либо за счет вибраций пьезоэлектрического модуля;
в) экструзия (Extrusion, пневматическая и механическая) — частицы биополимера или гидрогеля с клеточным материалом инжектируются в виде капель через сопло либо за счет образования паровых пузырей при электрическом нагреве, либо за счет вибраций пьезоэлектрического модуля.
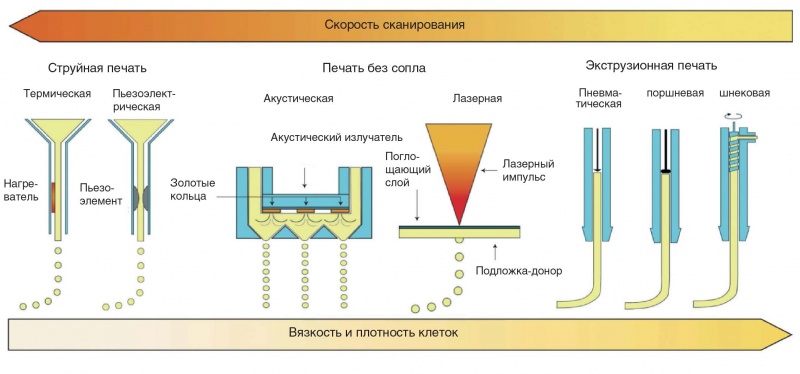
Рис. 4. Виды биопечати в зависимости от вязкости биочернил и плотности клеток, с одной стороны, и от скорости сканирования — с другой
Другие типы АМ (печать без сопла, например с помощью акустических волн) используются значительно реже.
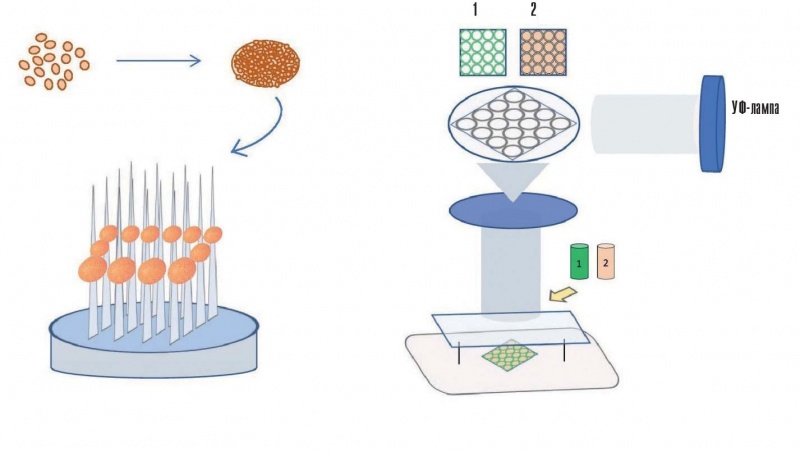
а) б)
Рис. 5. Виды биопечати: а) метод Kenzan (размещение клеточных сфероидов на микроиглах как на поддержке); б) метод стереолитографии (печать основным — зеленый — и поддерживающим — бежевый — материалами) — отверждение фотополимера за счет облучения УФ-светом лампы или лазера
2.1. Струйная биопечать (термическая и пьезоэлектрическая)
Струйный термический принтер имеет камеру с чернилами. Для создания потока капель на нагревательный элемент подаются импульсы тока, которые нагревают сопло головки до 200–300°C [13]. Кратковременный нагрев до таких температур не оказывает видимого разрушительного воздействия на биологические молекулы, включая ДНК и живые клетки.
Пьезоэлектрический струйный принтер использует пьезокристалл, на который подается импульс тока, и вследствие вибрации кристалла чернила выходят из сопла. Размер, форма капель и скорость их выброса определяются приложенным напряжением, длительностью и амплитудой импульса. К недостаткам следует отнести возможность повреждения клеточных мембран или стенок клеток акустическими волнами.
Благодаря своей доступности, быстрой печати и экономичности струйные принтеры имеют широкий спектр применения. Однако эффективность термоструйных принтеров снижается из-за закупорки сопла, неравномерного потока и разброса размеров капель [13]. Для преодоления некоторых проблем были разработаны различные модификации струйных принтеров.
Сложная конструкция тканей и органов требует одновременного нанесения различных типов клеток и других компонентов ткани, что стало возможным с появлением струйной печати с помощью матрицы сопел.
Как вариант предлагается струйный принтер с использованием постоянно приложенного пневматического давления с набором электромеханических микроклапанов. Принтер работает с биоматериалами с вязкостью до 200 Па•с, и за счет регулировки давления в канале и длительности закрытия и открытия клапанов (до 200 мкс) можно изменять объем капель.
Другой тип струйной печати включает в себя электрогидродинамическое распыление (ЭГДР), которое связано с применением разности электрических потенциалов между положительно заряженной иглой и заземленным электродом для создания отталкивающей кулоновской силы. В ходе передачи заряженной среды от иглы в электрическое поле высокой интенсивности происходит выброс капли размером от микрометра до нанометра. ЭГДР эффективно при распылении концентрированных суспензий с помощью нескольких игл размерами в сотню микрометров, которые могут легко генерировать капли материала размерами от микрона и меньше.
Размер капли при стандартной струйной печати составляет 10–50 мкм в диаметре, он примерно вдвое больше диаметра сопла. При этом объем капли может быть 1–100 пиколитров.
В струйной биопечати поверхностное натяжение является важным параметром, который определяет характер инжектирования материала — в виде капли или струи. Поверхностное натяжение уменьшается с увеличением концентрации клеток в биочернилах, поскольку все больше клеток адсорбируются на границе раздела жидкость–газ [14].
Методы гелеобразования (отверждения материала) основаны на физических, химических свойствах материалов, а также на использовании фотополимеризации для обеспечения устойчивости печатаемых объектов. Процесс отверждения должен происходить сразу после выхода материала из сопла при печати, в противном случае при более раннем отверждении (внутри печатающей головки) в сопле возникают закупорки, а при позднем — конструкция теряет форму.
К недостаткам метода относится негативное влияние на жизнеспособность клеток напряжения сдвига при отрыве капли от сопла головки. Как результат в струйных биопринтерах используются биочернила с низкой вязкостью (<10 мПа•с) и невысокой плотностью клеток (<106 клеток/мл) (рис. 4 и таблица 3) [15].
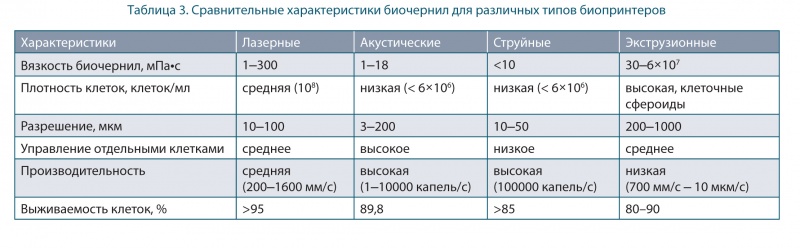
Несмотря на эти ограничения, струйные биопринтеры успешно применяются с хорошим разрешением (10–50 мкм) для осаждения клеток и работают с различными биочернилами.
2.2. Лазерная капельная биопечать
Метод биопечати без использования сопла (LIFT — laser-induced forward transfer), который включает в себя импульсный лазерный источник, донорный слой (состоит из поглощающего энергию лазера слоя золота или титана и слоя биочернил) и приемную подложку. Луч лазера фокусируется в точке на донорном слое, где образуется пузырь высокого давления за счет локального испарения биочернил, который в конечном итоге выбрасывает каплю материала на подложку. Объем капли от 10 до 7000 мкл, разрешение печати 10–100 мкм. Можно использовать биочернила высокой вязкости (1–300 мПа•с) с большой плотностью клеток (до 108 клеток/мл) [15]. Поскольку в данном методе не используется сопло для инжектирования материала, то снимаются проблемы с засорением сопел головок, а также с влиянием высокого напряжения сдвига на выживаемость клеток при отрыве клеток от сопла.
Другой метод биопечати без сопла использует поверхностные акустические волны, которые генерируются с помощью пьезоэлектрического эжектора. Последний представляет собой подложку из кварца, ниобата лития и др. с гребенкой из золотых колец на внешней поверхности подложки. Благодаря круговой геометрии волн на границе раздела воздух–жидкость в микроканале создается акустическая фокальная плоскость, в результате воздействия акустического давления капли биочернил выбрасываются из микроканала. Капли имеют одинаковый диаметр в диапазоне от 3 до 200 мкм, размер капель устанавливается путем изменения длины волны акустического эжектора. Поскольку клетки в биочернилах при построении конструкции не подвергаются воздействию геометрии сопла, нагрева или высокого давления, то метод обеспечивает высокую выживаемость клеток при печати (> 89,8%). Используются биочернила с различными поверхностными натяжениями и вязкостью (рис. 4 и таблица 3) [15].
2.3. Экструзионная биопечать
Считается широко распространенным и экономически эффективным методом в биотехнологии. Она включает в себя систему дозирования (эжектор, один или несколько) и автоматизированную трехосевую роботизированную платформу. Существует три типа дозирующих систем: пневматическая, механическая (поршневая или винтовая) и микроэкструзия с использованием соленоида. На подложку вместо капель, как при струйной или лазерной печати, подается нить диаметром 150–300 мкм. Пневматический подход связан с применением сжатого воздуха для выталкивания нитей (с клапаном или без него). Благодаря контролируемым давлению и частоте импульсов конфигурация с клапаном является более точной по сравнению с конфигурацией без клапана. В отличие от пневматической системы, поршневая система обеспечивает прямой и более простой метод управления. Винтовая механическая система имеет более точное управление и может работать с биочернилами с высокой вязкостью и высокой плотностью клеток, включая клеточные сфероиды (рис. 4, таблица 3). Однако большие перепады давления при этом могут разрушить клеточные мембраны [11].
Точное изготовление сложных конструкций, спроектированных с использованием CAD, достигается за счет высокого разрешения систем микроэкструзии. Обычно для микроэкструзионной биопечати используют термически сшитые материалы и/или материалы, обладающие свойствами разжижения при сдвиге.
Новый подход к экструзионной печати «гель-в‑геле» был предложен в работе [11]. Здесь основной материал — биочернила — экструдируются в поддерживающий материал — самозалечивающийся гель. Поддерживающий гидрогель деформируется при экструзии внутрь напечатанного каркаса и немедленно восстанавливается, заполняя весь внутренний объем. Механические свойства напечатанной конструкции можно улучшить, если добавить дополнительное сшивание за счет использования фотополимера в биочернилах. Кроме того, в сочетании с фотосшиванием, когда биочернила или гидрогель-носитель является фоточувствительным, можно создать автономные трехмерные структуры или структуры с пустотами путем вымывания неотвержденного гидрогеля. Этот метод печати «гель-в‑геле» годится для печати нескольких материалов, и, поскольку гидрогели разжижаются при сдвиге, печать с клетками также обеспечивает их высокую жизнеспособность (> 90%).
Отличие еще одного метода экструзионной биопечати от экструзионной клеточной биопечати заключается в использовании летучих органических растворителей для образования трехмерных структур. Исходный раствор с высокой вязкостью преобразуется в твердые трехмерные каркасы путем растворения полимеров из летучих органических растворителей. Здесь клетки полностью отделены от органических растворителей, они культивируются на поверхности каркаса для регенерации тканей/органов [11].
Сильные стороны экструзионной биопечати:
— обеспечивает равномерное распределение клеток вследствие их высокой плотности;
— экономит время;
— легкость в управлении;
— можно использовать широкий спектр биочернил, включая клеточные агрегаты, насыщенные клетками гидрогели, синтетические полимерные волокна, микроносители, децеллюляризованные матрицы;
— обеспечивает до 95% жизнеспособности клеток под воздействием различных факторов, таких как рабочее давление, размер сопла, сшивающие свойства гидрогелей.
К слабым сторонам экструзионной печати можно отнести следующее:
— высокое давление сдвига, ограничивающее печать гидрогелей с клетками;
— ограниченный выбор материалов для печати;
— низкое в сравнении с другими методами разрешение печати (200–1000 мкм);
— степень выживаемости клеток (40–86%) находится в обратной зависимости от давления экструзии и размера сопла.
Соответственно повышение размера сопла и снижение давления может повысить производительность печати.
Микроэкструзионные био-принтеры были использованы для биопечати различных типов тканей, таких как клапаны аорты, разветвленные сосудистые структуры, фармакокинетика in vitro и модели опухолей [13].
2.4. Биопечать на синтетической основе
В отличие от клеточной биопечати, бесклеточная 3D-биопечать (экструзионная и лазерная) имеет широкий спектр возможностей для выбора метода и материала. Бесклеточные биочернила могут быть использованы в вышеупомянутых методах клеточной биопечати для изготовления каркасов в тканевой инженерии, а 3D-биопечать тканей/органов может быть выполнена с помощью дополнительной техники посева клеток [11].
Технология послойного выращивания модели за счет укладки расплавленной нити полимера (FDM-технология) применяется при изготовлении каркаса в тканевой инженерии. В этом методе нить нагревают до температуры размягчения и через сопло выталкивают на подложку, на которой в соответствии с CAD-программой послойно выращивается модель.
Принтер включает в себя греющий блок с регулируемой температурой, головку с соплом для подачи материала и систему перемещения головки. Используются два типа подачи материала — пневматический и механический.
Примеры построений каркасов по методу FDM:
1. В работе [16] рабочим материалом для трансплантата кости послужила смесь композитов поликапролактона (PCL), поли (молочно-гликолевой кислоты) (PLGA) и β-трикальцийфосфата и минерализованного ECM (внеклеточного матрикса).
2. Lee at al [17] использовали для регенерации тканей нанесенные в расплавленном состоянии и обработанные плазмой каркасы из PCL, на которые был нанесен хитозан различной молекулярной массы.
В работе [14] были исследованы внутренняя структура и механические свойства каркасов гидроксиапатит/поликапролактон (HA/PCL), полученных методом 3D-печати (FDM).
Каркасы должны обеспечивать поддержку поврежденной костной ткани и иметь поры размерами от 100 до 500 мкм, чтобы обеспечить остеоинтеграцию и транспорт питательных материалов. Для тестирования использовались материалы micro HA/PCL и nano HA/PCL (рис. 6), причем результаты с nano HA/PCL получились более предпочтительными для производства костной ткани.
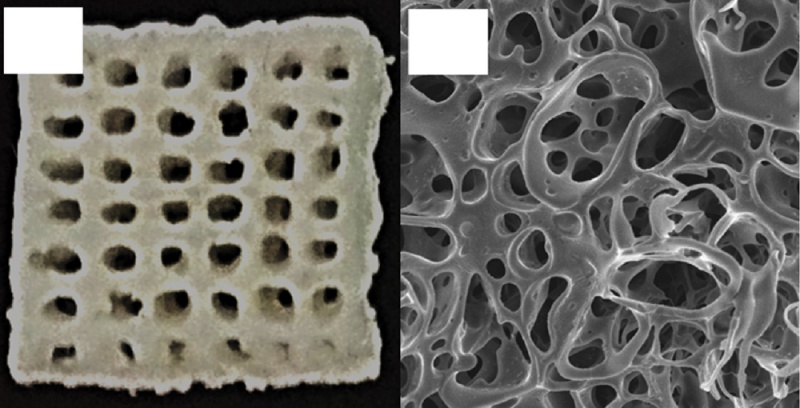
а) б)
Рис. 6. Вид пористой структуры ткани-каркаса: а) мфакроизображение, b) наноизображение
Достоинства метода FDM:
—простота эксплуатации,
—высокая скорость печати,
—широкий спектр синтетических биоматериалов, обладающих хорошими механическими свойствами и биосовместимостью (поли (капролактон) (PCL), поли (молочная кислота) (PLA), полиуретан и их производные).
Ограничения:
— требование высокой температуры для расплавления нити, которое делает среду неблагоприятной для клеток при биопечати каркасов.
Дешевые 3D-принтеры, работающие по технологии FDM (Maker Bot, Ultimaker, Flashforge и Prusa) имеют ограниченное применение из-за низкого разрешения печати и ограниченного набора используемых материалов в отличие от более дорогих и более совершенных 3D-принтеров Stratasys.
2.5. Лазерная биопечать
1. Биопечать на основе стереолитографии (SLA).
Техника стереолитографии с биопечатью впервые появилась в 1980‑х годах. Послойное отверждение фотополимера происходит за счет облучения УФ-лампой проецируемого изображения
слоя-маски в ванне или послойным отверждением сканирующим лучом лазера. Управлять процессом биопечати, в частности разрешением, можно за счет изменения длины волны, мощности, времени экспозиции и скорости сканирования, размера лазерного пятна, поглощения или рассеяния лазерного луча, а также концентрации фотоинициатора или любых поглотителей ультрафиолетового излучения [11].
Для проецирования изображения маски слоя используется цифровое микрозеркальное устройство обработки света (DLP), которое эффективно отверждает один целый 2D-слой. Поэтому по сравнению с процессом сканирования лазерным лучом проекционная печать маски изображения является более быстрой техникой.
Биопечать на основе SLA обычно использует несколько типов фотоотверждаемых биочернил, включая метакрилатные/акрилатные природные биоматериалы (желатин, гиалуроновая кислота, декстран и другие, полиэтиленгликольакрилат/метакрилат и его производные и метакрилат/акрилат, покрытый другими синтетическими полимерами [11].
Лазерная биопечать использует лазерный луч в качестве источника энергии для осаждения биочернил с клетками на подложку для получения высокоточных литых шаблонов. Метод позволяет эффективно осаждать биочернила с высокой плотностью клеток и высокой вязкостью.
Достоинства SLA-методов биопечати:
— печать сложных структур с высоким разрешением;
— печать с высокой скоростью и за меньшее время;
— построение сложных структур без поддерживающих материалов;
— системы µSLA эффективны при создании элементов с малыми размерами (до 50 мкм), при этом размер наименьшего фрагмента может быть менее 5 мкм.
Недостатки SLA биопечати:
— образование свободных радикалов во время фотополимеризации, вызывающее потенциальное повреждение клеточной мембраны, белков и нуклеиновых кислот,
— меньшая доступность фотоотверждаемых материалов,
— дорогостоящее оборудование.
Техника стереолитографии также связана с изготовлением синтетических каркасов.
2. Другой метод лазерной печати каркасов включает послойное селективное лазерное спекание (SLS) различных материалов: керамики, металлов и композитов. Поддержкой является неспеченный порошок, из которого извлекается готовое изделие после построения, сам неспеченный порошок направляется для повторного использования. На качество построения влияют различные факторы: размер и форма частиц, плотность свободной упаковки, источник энергии и термодинамические изменения материалов. Диапазон разрешения от 20 до 100 мкм. К достоинствам SLS-метода можно отнести легкодоступность биоматериалов (обычно в виде порошков), но высокая стоимость оборудования, сложность и трудоемкость метода наряду с невысоким разрешением ограничивают применимость лазерной биопечати.
3. Селективное термическое спекание (СВС) — технология, связанная с использованием термопечатающей головки вместо лазера для послойного построения структур путем плавления поверхности порошкообразных термопластиков. СВС не нашла широкого применения в 3D-биопечати.
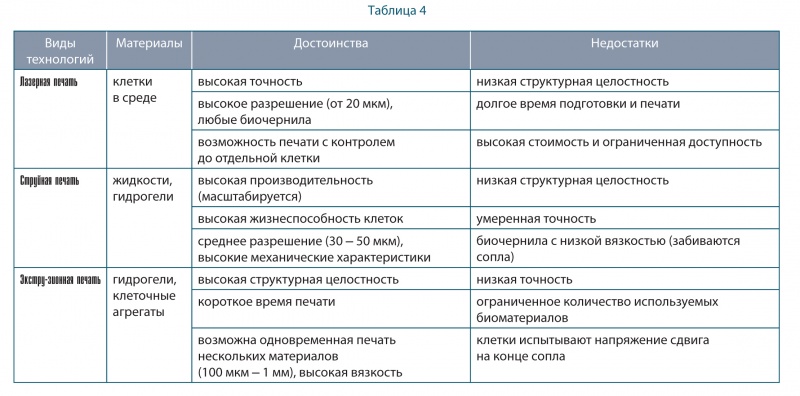
В таблицах 4, 4–1 представлены сравнительные характеристики основных технологий биопечати.

2.6. Электроспиннинг
В Университете штата Пенсильвания (Penn State University, США) открыли революционный способ печати тканей и органов [18] — электроспиннинг (electrospinning, ES) — метод переплетения полимерных волокон с клетками для создания каркасов на основе коллагена при выращивании тканей (рис. 7). Эта технология более дешевая и обеспечивает хорошую точность и больший контроль над строящимися каркасами. Так, ученые из Rice’s Brown School of Engineering [19] в отделе биоинженерии смогли напечатать орган, который имитирует легкие.
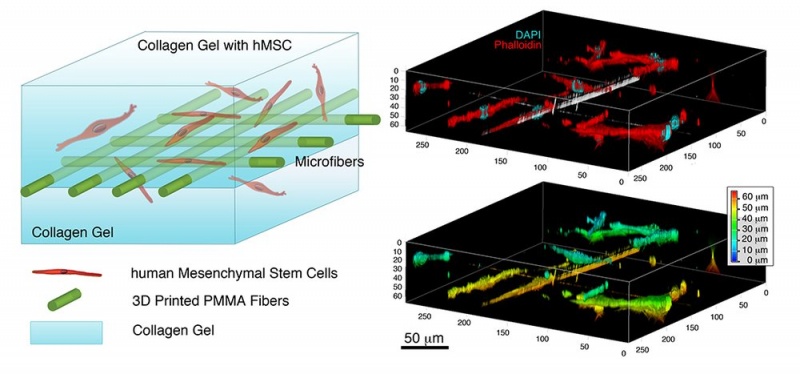
Рис. 7. Каркасы из волокна (microfibers) по методу электроспиннинга с гидрогелем с коллагеном (collagen) и стволовыми клетками человека (hMSC)
Justin Brown, один из авторов исследования, пояснил: «Мы пытаемся сделать гидрогели со стволовыми клетками, армированными волокнами аналогично арматуре в цементе. Если мы сможем придать гелю некоторую структуру, мы сможем выращивать живые клетки определенным образом, и в конечном итоге волокна растворятся и исчезнут».
Многие из проблем, указанных в таблице 4, 4–1, можно было бы устранить, если бы была доступна сборка клеточных конструкций без биоматериала (т. е. бескаркасная сборка). Было предложено использовать только клетки и матрицы, в которых они находятся. В частности, применялись неорганические материалы, например, гидрогели, в виде цилиндрических нитей с клетками внутри, которые разрезались на короткие фрагменты и повторно использовались для печати структур. При этом вспомогательные материалы (гидрогелевый каркас) удалялись [20].
Другой пример — подготовка длинных клеточных цепочек в трубках из альгината (гидрогелевый каркас), каркас затем удаляется, а подготовленный клеточный материал используется для биопечати с помощью экструзионного принтера. Основная задача в этом методе — использование клеток, подготовленных специальным образом: в виде блоков, сфероидов, клеточных листов или цилиндров, собранных во внеклеточной матрице [21].
Использование сфероидов в качестве строительных блоков в биопечати позволяет создавать крупные конструкции, которые живут по тем же законам биологии, что и сфероиды, в отличие от ограничений, существующих для биоматериалов.
Интересное решение было предложено для биопечати сложных структур (например, таких, как клапаны) — использование свойств магнитной левитации. В этом методе клетки собираются в тканевой культуре на поверхности жидкости, а не на ее дне. Поскольку процедура помещения сфероидов в нужное место довольно затруднительна, было предложено использовать магнитную биоручку, с помощью которой можно манипулировать сфероидами [22].
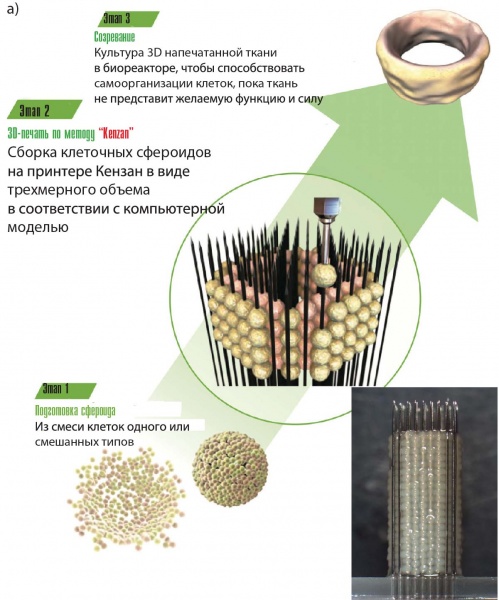
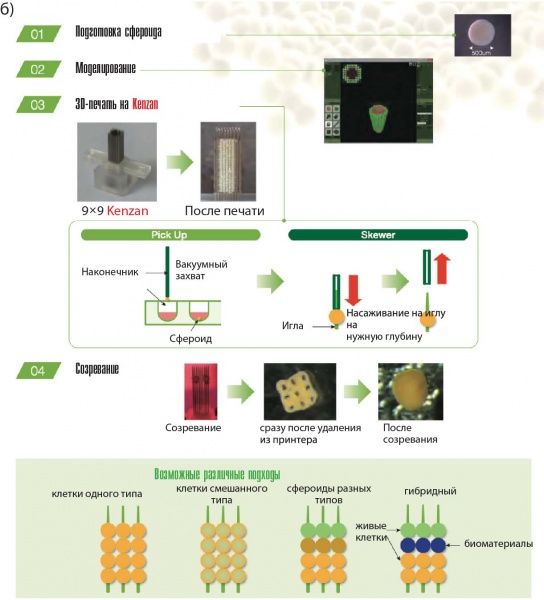
2.7. Метод Kenzan
Метод Kenzan (рис. 5а) разработан в Японии (компания Cyfuse Biomedical K. K., принтер Regeno-va, рис. 8) для пространственной организации сфероидов с использованием микроигл. В основу метода положено искусство икебана. Размещенные с помощью робота сфероиды на микроиглах создают внеклеточную матрицу, где сфероиды могут взаимодействовать друг с другом. Иглы из нержавеющей стали толщиной 160 мкм размещены в виде матрицы (например, 9×9 или 26×26 игл) на расстоянии 500 мкм. Сфероиды должны иметь диаметр 400–600 мкм и содержать не менее 20000 клеток.
в) 

Рис. 8. Биопринтер Regenova: а) основные этапы выращивания готовых тканей, б) технологический процесс с использованием принтера Kenzan, в) внешний вид
Особенности метода Kenzan:
— размер сфероидов определяется расстоянием между иглами, чтобы обеспечить их контакт между собой. Поэтому важно уметь получать сфероиды нужного размера;
— другая причина ограничения размеров сфероидов связана с пределом диффузии кислорода (200 мкм) и питательных ве-ществ.
Преимуществом метода Kenzan является сходство с некоторыми аспектами биологии развития опухолей, которые обычно игнорируются или не учитываются при биопечати с использованием биочернил. В сфероидах задействованы многие известные биофизические и биологические механизмы, которые могут быть рационально включены и более эффективно использованы для целей тканевой инженерии.
Метод Kenzan реализован в биопринтере Regenova (рис. 8). Принтер имеет блок хранения сфероидов (два магазина по 10 планшетов с 96 гнездами каждый) и рабочий магазин для транспортировки планшетов. Изображения сфероидов в планшетах и кончиков игл анализируются специальным софтом для проверки качества, гнезда с несоответствующими по форме и размерам сфероидами не используются при печати. Набор игл хранится в стерильном резервуаре. Подвижная головка со сфероидом перемещается в нужное положение, устанавливается над иглой и насаживает сфероид на иглу. Можно создавать конструкции с заранее разработанными сфероидальными слоями высотой в 10 мм и более. Затем процесс повторяется, так что заполнение одного планшета сфероидами занимает до 20 минут. Держатели массива игл имеют сквозную полость внутри для прокачки питательного раствора и могут легко сниматься. Головка при необходимости может очищаться продувкой воздухом.
С помощью биопринтера Re-genova были выращены сосуды диаметром 5 мм и длиной 20 мм с использованием человеческих эндотелиальных клеток, гладкомышечных клеток и фибробластов (рис. 9). Они показали достаточные биомеханические свойства, чтобы выдерживать хирургические манипуляции, и показали хорошую приживаемость после имплантации крысам.
Похожая технология была предложена исследователями из Государственного колледжа штата Пенсильвания, США — метод aspiration-assisted bioprinting (AAB), когда ткани выращивают за счет точной установки сфероидов в систему из предварительно изготовленных каркасов либо просто при формировании объема из сфероидов (рис. 9).

а)
б)
в)
г) Рис. 9. Метод ABB: а) сфероид с помощью пипетки помещается на отпечатанную на биопринтере подложку; б) сфероиды в виде отпечатанной на биопринтере модели без каркаса; в) сфероиды могут быть впечатаны на биопринтере в каркас при изучении лекарств или моделирования заболевания; г) сфероиды создают сеть капилляров для снабжения ткани кислородом и питательными веществами.
Рис. 9. Метод ABB: а) сфероид с помощью пипетки помещается на отпечатанную на биопринтере подложку; б) сфероиды в виде отпечатанной на биопринтере модели без каркаса; в) сфероиды могут быть впечатаны на биопринтере в каркас при изучении лекарств или моделирования заболевания; г) сфероиды создают сеть капилляров для снабжения ткани кислородом и питательными веществами.
Фото: Университет штата Пенсильвания (Penn State)
2.8. Электрогидродинамический метод
Еще один перспективный метод биопечати — электрогидродинамический 3D-принтер (EHD) высокого разрешения [23, 24], в котором жидкие чернила в электростатическом поле способны образовывать капли или струю, размеры которых меньше диаметра сопла. Максимальная высота печати модели была ограничена расстоянием между срезом сопла и подложкой, поскольку необходимо сохранять однородное электростатическое поле. Для большинства подобных принтеров нижний электрод заземления был расположен под подложкой. Были предложены различные решения с расположением электродов: а) в виде двух параллельных слоев с изолятором между ними, б) лучшее решение — в виде кольца, интегрированного в головку с соплом (рис. 10).
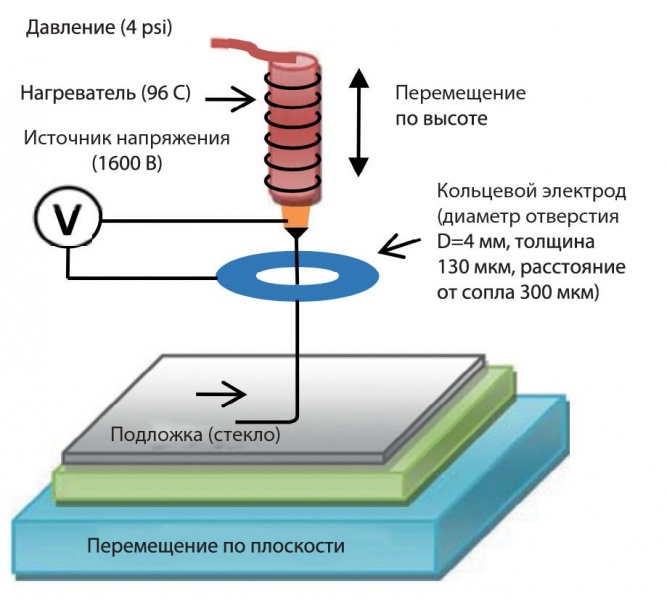 Рис. 10. Схема EHD 3D-принтера
Рис. 10. Схема EHD 3D-принтера
При напряжении в 1600 В между электродами начало инжектирования капель определяется расстоянием кольца от среза сопла (в среднем 2,5 мм). При этом разрешение печати составило примерно 10 мкм (для материала PCL).
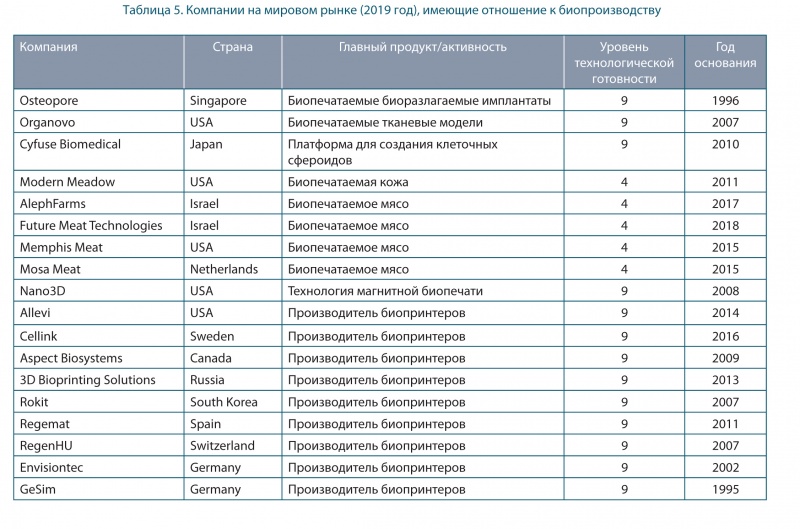
Основные игроки на рынке оборудования и услуг для био-производства представлены в таблице 5.
Примеры растущего использования аддитивных технологий в биопроизводстве будут представлены во второй части статьи, а различные аспекты применения АМ, включая стандартизацию, социальные проблемы, а также тенденции развития будут рассматриваться в третьей части. ■
Автор: Н.М. Максимов, ООО «Ника-Рус»
Источник журнал "Аддитивные технологии" № 2-2020



