По мере освоения аддитивных технологий в исследовательских целях переход к широкому применению АМ в биопроизводстве занимает меньшее время.
Основные направления применения:
— планирование хирургических операций, в том числе 3D-печать при обучении, для визуализации, для коммуникаций,
— изготовление протезов,
— выращивание тканей, в т. ч. 3D-печать кожи, печать костей и хрящей, замена тканей, замена органов, использование при исследованиях рака,
— печать лекарств, в том числе исследования лекарственных средств и фармацевтики.
Достоинства 3D-биопечати:
— возможность копировать природную структуру кожи с меньшими затратами. Отпечатанная кожа может использоваться для тестирования фармацевтических, косметических и химических препаратов. Поэтому отпадает необходимость в использовании кожи животных для таких целей. А получить точные результаты можно на выращенных копиях натуральной кожи;
— возможность напечатать лекарственные препараты в нужном месте в нужное время увеличивает эффективность, дает точный контроль за размерами и дозой препарата в соответствии с заранее заданным сложным профилем применения.
Особенно это важно для малоустойчивых лекарств, которые деградируют при хранении:
— способность напечатать хрящи и кости для заполнения в них пустот, полученных в результате травм или болезни. В этом отличие от аутотрансплантации, когда используется кость или ткань из другого места самого пациента, а также от аллотрансплантации, когда нужная ткань или кость берутся у донора. В данном случае решается задача выращивания кости или ткани в самом теле пациента с тем, чтобы поддержать или улучшить его функции;
— печать тканей для замены, восстановления, поддержания или улучшения функции имеющейся ткани. Напечатанная ткань имеет пористую внутреннюю структуру, соответствующую химию поверхности, хорошие механические свойства, обладает биосовместимостью;
— печать аналогов органов, у которых имеются критические проблемы, связанные с болезнью, травмой или дефектами при рождении;
— при раковых заболеваниях возможно напечатать высокоточную модель раковых тканей для ускорения исследования. В этом случае можно получить более надежные и точные данные;
— для нейрохирургов важно иметь напечатанные модели при подготовке операции. Помимо повышения точности это позволяет сократить время при проведении клинических процедур, а также провести необходимые манипуляции своими руками, поскольку модель является копией реальных патологических условий пациента.
Планирование хирургических операций
За основу берутся изображения операционной зоны, полученные с помощью компьютерной томографии (КТ), магнито-резонанской томографии (МРТ) и ультразвуковой визуализации (УЗ). Информация конвертируется в STL-файлы (например, программа Mimics, Materialise) для печати на соответствующем 3D-принтере нужной части тела, после постобработки готовая модель передается бригаде хирургов для разработки плана операции. К примеру, врожденные пороки сердца наиболее сложны для проведения операций у детей из-за малых по сравнению с взрослыми размеров сердца. Как правило, анатомическая модель сердца с основными сосудами печатается методом стереолитографии, она дает полное представление о размерах и структуре дефекта и позволяет спланировать пошаговый алгоритм операции. Таким способом, например, были проведены операции на сердце для трехмесячного ребенка и для 15-летнего мальчика по установке стента в аорте, где размеры и оптимальное расположение стента определялись по анатомической модели. Самые сложные и рискованные операции связаны с пересадкой сердца, особенно если ранее уже проводились какие-либо операции на сердце пациента. В этом случае создание анатомической модели для тщательного планирования операции обязательно.
Другие применения АМ для создания анатомических моделей и планирования операций связаны с операциями на мозге (нейрохирургия), в бронхоскопии (модель трахеобронхиального дерева), а также для создания шаблонов, которые помогают хирургам направлять хирургическую вставку винтов и пластин внутренней фиксации во время операции. Все это приводит к сокращению времени операции, уменьшению интраоперационного кровоизлияния и уменьшению радиационного облучения пациентов и персонала во время операции.
Анатомическая модель органа может быть напечатана одновременно разными материалами различных цветов при использовании 3D-принтеров с матричной головкой с сотнями инжекторных сопел. Так, например, цветом можно выделять нервы, кровеносные сосуды, костную ткань и т. д.
Ограничения в использовании 3D-печати анатомических моделей связаны с высокой стоимостью и длительной процедурой получения модели. Кроме того, модель нельзя представить в динамике, как, например, работающее сердце. Нельзя забывать и о риске облучения персонала и пациента при использовании томографии.
Системы доставки лекарств
Синтетические биоматериалы специально разработаны для взаимодействия с биологическими системами для терапевтических или диагностических медицинских целей, в частности, для доставки лекарств и интеллектуальных терапевтических средств [1]. Достигается это за счет разработки и изготовления гидрофильных материалов на основе полимеров или гидрогелей и включения их в строящиеся каркасы, которые становятся чувствительными к различным физиологическим стимулам (например, pH, температуре или концентрации соли).
Выращивание тканей
В работе [2] представлены результаты использования плюрипотентных (многофункциональных) стволовых клеток человека (hPSCs) для выращивания моделей in vitro. Они включают эмбриональные стволовые клетки (hESCs) и индуцированные плюрипотентные стволовые клетки (hiPSCs). Эти клетки могут быть фактически преобразованы в клетки любого типа (плюрипотентность), например, печени, сердца, сосудов, роговицы и хряща и в перспективе нейронов и наделены неограниченной способностью к самообновлению (стеблезность). Здесь hASCs: жировые стволовые клетки; HUVECs: линия эндотелиальных клеток пупочной вены человека; HCF: фибробласты желудочка сердца человека.
Поскольку биомедицинские применения требуют дифференцировки hiPSC в типы клеток, соответствующие заболеванию, разработка надлежащих методов дифференцировки является обязательной для полного использования их потенциала. Однако создание полного разнообразия подтипов клеток, из которых состоят человеческие органы и ткани, остается проблемой. Это в основном обусловлено некоторыми специфическими характеристиками hPSC, которые затрудняют биопечать для таких клеток. Во-первых, hPSCs показывают плохую выживаемость в культуре отдельных клеток, а диссоциация на отдельные клетки является необходимым шагом в большинстве процедур биопечати. Во-вторых, hPSCs очень чувствительны к сигналам окружающей среды из-за их внутренней природы эмбрионально-подобных клеток, способных реагировать на сигналы развития. В-третьих, hPSCs, как правило, образуют кластеры или колонии из-за их эпителиального характера. Эта склонность должна учитываться при использовании биопечати инфекционного типа.
Применение 3D-биопечати к hPSCs — это перспективная область, которая находится сегодня в процессе интенсивного развития. Исходные клетки hPSC могут быть использованы при экструзионной и лазерной биопечати, а затем индуцированы для дифференцировки либо в несколько линий, либо в специфический тип клеток, представляющий интерес. Этот процесс определяются как «дифференциация после печати». Печать с клетками с фиксацией клонов, ранее полученных путем дифференциации клеток hPSC, определяется как «предпечатная дифференциация» (таблица 1).
Биопечать ткани печени
В Центре исследования генома человека и стволовых клеток (Human Genome and Stem Cell Research Center, HUG-CELL) в Университете Сан-Паулу (Бразилия) группа исследователей получила печеночные органоиды («мини-печень»), которые выполняют все типичные функции печени, такие как производство жизненно важных белков, хранение витаминов, выделение желчи и др. [14]. Методика в будущем может стать альтернативой трансплантации органов. Ее важным преимуществом является нулевая вероятность отторжения, учитывая, что клетки взяты от пациента.
Это исследование объединило биоинженерные методы с трехмерной биопечатью. Благодаря этой стратегии ткань, произведенная биопринтером, дольше сохраняла функции печени, чем сообщалось другими группами в предыдущих исследованиях. Для печати были использованы сфероиды, полученные из клеток.
«В самом ближайшем будущем вместо того, чтобы ждать трансплантации органов, может стать возможным взять клетки у пациента и перепрограммировать их для создания новой печени в лаборатории», — сказала M. Zatz, директор HUG-CELL.
Образование сфероидов в этом исследовании уже происходило в процессе дифференцировки, когда плюрипотентные клетки трансформировались в клетки ткани печени (гепатоциты, сосудистые клетки и мезенхимальные клетки). Весь процесс от забора крови пациента до производства функциональной ткани занимает около 90 дней и может быть разделен на три этапа: дифференциация, печать и созревание.
Первоначально клетки крови перепрограммируются, чтобы регрессировать до стадии плюрипотентности, характерной для стволовых клеток, превращаясь в индуцированные плюрипотентные стволовые клетки (hiPSC). Японский ученый Шинья Яманака был удостоен Нобелевской премии по медицине 2012 года за разработку этой методики. Следующий этап состоит в проведении дифференцировки hiPSC в клетки печени. Сфероиды затем смешиваются с биочернилами и отправляются в печать. Полученные структуры созревают в культуре в течение 18 дней.
В этом исследовании ученые разработали мини-печень с использованием клеток крови трех добровольцев в качестве сырья и сравнили маркеры, относящиеся к функциональности, такой как поддержание контакта с клетками, а также производство и высвобождение белка. «Наши сфероиды работали намного лучше, чем те, которые были получены в результате одноклеточной дифференцировки. Как и ожидалось, во время созревания маркеры функции печени не снижались», — сказал Goulart, один из авторов статьи.
Хотя исследование было ограничено производством миниатюрной печени, методика может быть использована в будущем для производства целых органов, пригодных для трансплантации, согласно Goulart.
Сетчатые пластыри
Детям с врожденной грыжей диафрагмы часто требуется хирургическое закрытие дефекта с помощью специального пластыря. Клиническая эффективность сетчатых пластырей ограничена осложнениями, связанными с остаточным инородным материалом, и рецидивом грыжи. В работе [15] показан опыт создания с помощью 3D-биопечати больших бескаркасных пластырей из ткани на основе клеток человека, обладающих высокой эластичностью и прочностью. Трубчатые ткани выращивались из MCS (многоклеточных сфероидов из фибробластов) на 3D-принтере Regenova с использованием метода Kenzan [16, 17]: короткие трубки на матрице из нержавеющих игл 9×9, длинные трубки — на матрице из игл 34×34. После выдержки в биореакторе со специальной циркулирующей средой в течение 7 недель трубки разрезались на плоские пластыри (4×5×1 мм) для имплантации.
Клеточные пластыри были трансплантированы крысам с хирургически созданными дефектами диафрагмы. Крысы выживали в течение более 710 дней после имплантации тканевых конструкций. КТ подтвердила полную тканевую интеграцию трансплантатов во время роста крыс. Гистология выявила регенерацию мышечной структуры, сосудистой системы и нейронных сетей в реконструированных диафрагмах.
Клеточные пластыри также могут быть использованы при лечении дефектов в других системах, включая врожденные структурные аномалии тонкой кишки и мочевой системы.
В работе [18] показана возможность выращивания с помощью экструзионного биопринтера пластыря для устранения дефекта сердца с использованием полностью аутологичных материалов. У пациентов была взята биопсия жировой ткани, клетки были перепрограммированы в плюрипотентные стволовые клетки, а внеклеточный матрикс (ESM) был преобразован в гидрогель. После смешения клеток и гидрогеля клетки были эффективно дифференцированы в сердечные клетки для создания специфических для пациента иммуносовместимых сердечных пластырей. Однако эти сердечные пластыри не содержали сети кровеносных сосудов, которые соответствуют анатомической архитектуре сосудистой сети пациента. Наличие такой сосудистой сети является критическим для выживания и функционирования пластыря после трансплантации. Далее было показано, как гидрогель в сочетании с собственными клетками пациента может использоваться для печати толстых пластырей сердца с сетью кровеносных сосудов, которые полностью соответствуют иммунологическим, биохимическим и анатомическим свойствам пациента.
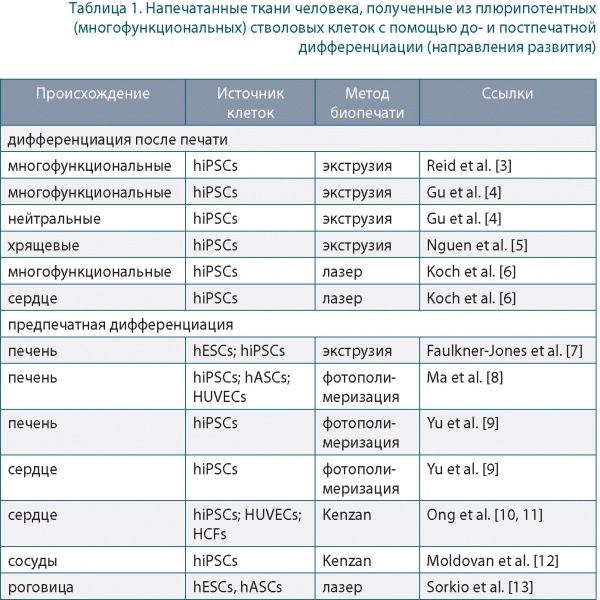
В перспективе персонализированный гидрогель можно использовать для печати объемных автономных клеточных структур, в том числе целого сердца с основными кровеносными сосудами. Крупные сосуды проектировались на основе компьютерной томографии, а мелкие сосуды выстраивались по CAD-модели (рис. 1).
 Рис. 1. Изображение сердца (a), коронарных артерий (b) и CAD-модель сосудистой системы (c) и разветвленной системы с улучшенным снабжением тканей кислородом (d)
Рис. 1. Изображение сердца (a), коронарных артерий (b) и CAD-модель сосудистой системы (c) и разветвленной системы с улучшенным снабжением тканей кислородом (d)
Похожая работа по биопечати пластырей для сердца была выполнена [19] с использованием метода Kenzan. Сфероиды были сделаны из кардиомиоцитов, полученных из hiPSC, смешанных с эндотелиальными клетками HUVEC и клеточной линией фибробластов сердца человека. Биопринтер (Regenova, Cyfuse Biomedical K. K., Tokyo, Japan) был настроен так, чтобы отбирать только сфероиды соответствующего размера перед сборкой их в массив игл (рис. 2). Результатом при последующем удалении из игольной группы было сердцебиение. Примечательно, что напечатанные сердечные пластыри были привиты и показали признаки васкуляризации при имплантации в сердца крыс.
 Рис. 2. Схема процесса биопечати сердца без биоматериалов
Рис. 2. Схема процесса биопечати сердца без биоматериалов
Биопечать роговицы
Ткани роговицы человека были созданы с помощью лазерной биопечати: для эпителия роговицы использовали биочернила на основе лимбальных эпителиальных стволовых клеток (LESC), полученных путем дифференцировки эмбриональных стволовых клеток человека hESC. Для конструирования слоистых структур, имитирующих строму роговицы, использовали стволовые клетки, полученные из жировой ткани человека (hASC) [20]. Основой для биочернил служили ламинин и коллаген I от человека.
Были напечатаны три типа роговицы: а) многослойный эпителий роговицы с использованием hESC—LESC, б) пластинчатая строма роговицы с чередованием бесклеточных слоев чернил и слоев с клетками hASCs, в) структура со стромальной и эпителиальной частью. Напечатанные стромальные конструкции были имплантированы в культуру органов роговицы свиньи. В работе использовались два лазерных биопринтера с разными длинами волн излучения. Результаты исследования показали, что после 7 дней пребывания в культурах органов свиньи напечатанные стромальные структуры прикрепились к тканям хозяина с признаками миграции клеток hASCs.
Это первое исследование, демонстрирующее возможность использования лазерной биопечати для применения на роговице с использованием стволовых клеток человека и успешного изготовления многослойных биопечатных тканей, имитирующих структуру природной ткани роговицы.
Построение трехмерных моделей мозга с помощью биопечати стволовыми клетками
Необходимость создания реалистичных моделей особенно актуальна для неврологических заболеваний. Межвидовые различия и специфические для человека особенности развития мозга не всегда воспроизводятся на животных. Кроме того, доступ к тканям головного мозга человека ограничен, и нейроны нельзя легко культивировать и расширять in vitro. Несмотря на то, что hPSCs дают возможность генерировать человеческие нейроны in vitro, обычные 2D-культуры нейронов, происходящих из hPSC, имеют несколько ограничений: они не имитируют сложную организацию мозговой ткани, межклеточные взаимодействия ограничены параллельными контактами, динамика питательных веществ, диффузия кислорода и удаление отходов отсутствуют. Органоиды головного мозга человека строятся путем самоорганизации дифференцирующихся hiPSCs по нервной линии. В настоящее время, к сожалению, воспроизводимость считается одной из основных проблем в этой области. Такой «периодический синдром» (Kela-va and Lancaster, 2016) можно частично устранить, руководствуясь самоорганизацией клеток с помощью волокнистых микрофиламентов, используемых в качестве плавающих каркасов для производства церебральных органоидов, сконструированных с помощью микрофиламентов (enCOR) (Lancaster et al., 2017).
Как пример, Gu et al. создали трехмерную конструкцию нейронной мини-ткани человека (nMTC) с помощью технологии микроэкструзионной печати. При этом использовали биочернила на основе альгината, карбоксиметилхитозана и агарозы с человеческими нейральными клетками. Дифференцировка в клетки нейронной ткани была проведена после печати. Две серии успешных экспериментов показали, что нейронные ткани человека могут быть выращены с помощью биопечати, и предполагают, что состав биочернил будет определять выживаемость клеток, их рост и пространственное распределение внутри печатных конструкций.
Приложение АМ в кардиологии
AM создает точную трехмерную анатомическую модель для объяснения, понимания и подготовки к сложным медицинским процедурам — это одна сторона, и создание искусственного сердца (не из биоматериалов!) — это другое применение АМ. Выращивание готового сердца как органа с использованием собственных клеток и имплантация его пациенту — это перспектива будущего.
Этапы использования АМ в кардиохирургии представлены в таблице 2.
| № п/п | Этапы | Описание | Выгоды | Ссылки |
|---|---|---|---|---|
| 1 | Получение изображения | Создание визуального представления внутренних частей тела, диагностика, выбор плана лечения болезни | Позволяет разграничить анатомию сосудов внутри и вне сердца |
Gómez- Ciriza, et al.[21]
|
| 2 | Сегментация | Создание 3D виртуальной модели сердца со всей структурой | Измерение объема ткани, изучение анатомии, планирование операции и отработка ее на виртуальном симуляторе | Dankowski et al. [22] |
| 3 | Компьютерное конструирование | Разработка CAD модели, подготовка STL файла для печати | Ускорить производство продуктов / медицинских имплантатов / инструментов | A.Haleem et.al [23] |
| 4 | 3D-печать | Выбор технологии 3D печати, в т.ч. биопечати (тип ткани, клеток и биоматериалов). Создание работающей модели для тестирования идей, конструктивных решений, функциональности и производительности | Высокая гибкость АМ технологии позволяет вносить изменения без дополнительного оборудования и инструментов. Изделие изготовлено точно под сложную внутреннюю структуру пациента | N.S.Birbara et al. [24] |
| 5 | Технология передается в клинику | Технология внедряется в клиническую практику. Помогает лучше понять болезнь и разработать и проверить средства лечения | Помогает в диагностике заболевания и выборе метода лечения. Анализ образца человека и сопоставление генетической информации пациента | K.Hadeed et al. [25] |
AM обладает потенциалом для лечения врожденного порока сердца и моделирования структурных вмешательств. В широком смысле это усилит междисциплинарное сотрудничество с участием клинических кардиологов, рентгенологов, специалистов по катетеризации сердца и хирургов. AM может стать повсеместным и необходимым инструментом для изготовления индивидуальных имплантируемых медицинских устройств, которые улучшают существующие терапевтические вмешательства. В будущем технологии 3D-печати могли бы печатать 3D-модель сердца с использованием интеллектуальных материалов, которые могут изменять свою форму и функциональность в зависимости от времени. Это так называемые технологии 4D-печати, которые применимы также для печати почки, печени и других органов с высокой гибкостью, идеальной посадкой и генетическим соответствием. Напечатанные модели могут расти в теле пациента в соответствии с ростом пациента.
Биопечать сердца (модель в масштабе)
Исследователи из Тель-Авивского университета создали на 3D-биопринтере первое в мире искусственное сердце (рис. 3) с сосудами, используя собственные клетки пациента и биологические материалы [26]. Правда, оно имеет размер сердца кролика. «Это первый случай, когда кто-либо где-либо успешно спроектировал и напечатал целое сердце, переполненное клетками, кровеносными сосудами, желудочками и камерами», — говорит руководитель проекта профессор Тал Двир из Школы молекулярной клеточной биологии и биотехнологии TAU.
 Рис. 3. Сердце человека, напечатанное в уменьшенном масштабе из биоматериалов пациента
Рис. 3. Сердце человека, напечатанное в уменьшенном масштабе из биоматериалов пациента
«Это сердце сделано из человеческих клеток и специфических для пациента биологических материалов. В нашем процессе эти материалы служат биочернилами, которые можно использовать для 3D-печати сложных моделей тканей», — говорит профессор Двир.
Для исследования у пациентов была взята биопсия жировой ткани. Клеточные и а-клеточные материалы ткани затем разделяли. В то время как клетки были перепрограммированы, чтобы стать плюрипотентными стволовыми клетками, внеклеточный матрикс (ECM), трехмерная сеть внеклеточных макромолекул, таких как коллаген и гликопротеины, были переработаны в персонализированный гидрогель, который служил «чернилами» для печати.
После смешивания с гидрогелем клетки были эффективно дифференцированы в сердечные или эндотелиальные клетки для создания специфичных для пациента иммунносовместимых сердечных пластырей с кровеносными сосудами и, следовательно, всем сердцем.
«Биосовместимость конструкционных материалов имеет решающее значение для устранения риска отторжения имплантата, что ставит под угрозу успех таких процедур», — говорит профессор Двир. «В идеале биоматериал должен обладать такими же биохимическими, механическими и топографическими свойствами, как и собственные ткани пациента. Здесь мы можем сообщить о простом подходе к 3D-печати толстых, васкуляризированных и перфузируемых тканей сердца, которые полностью соответствуют иммунологическим, клеточным, биохимическим и анатомическим свойствам пациента».
По словам профессора Двира, исследователи в настоящее время планируют культивировать печатные сердца в лаборатории и «учить их вести себя как сердца». Затем они планируют пересадить 3D-напечатанное сердце животным.
«Мы должны развивать печатное сердце дальше», — заключает он. «Клетки должны формировать насосную способность; они могут в настоящее время сокращаться, но нам нужно, чтобы они работали вместе. Мы надеемся, что мы добьемся успеха и докажем эффективность и полезность нашего метода».
«Возможно, через десять лет в лучших больницах мира появятся принтеры для органов, и эти процедуры будут проводиться регулярно».
Компания BIOLIFE4D из Иллинойса (США) также успешно напечатала с помощью биопринтера миниатюрное человеческое сердце со всей структурой реального сердца, включая камеры и желудочки (рис. 4), [27]. Работа была выполнена в исследовательском центре в JLABS в Хьюстоне под руководством главного научного сотрудника компании доктора Ravi Birla. Компания разработала запатентованные биочернила с использованием очень специфического состава различных соединений внеклеточного матрикса, которые близко повторяют свойства сердца млекопитающих. Для печати сердца как органа был разработан новый и уникальный алгоритм биопечати. Сочетая свои биочернила с кардиомиоцитами, полученными от пациентов, и свою технологию биопечати, BIOLIFE4D теперь имеет все возможности для развития на этой платформе полномасштабного человеческого сердца. А пока мини-сердце можно использовать для тестирования лекарств.
а) 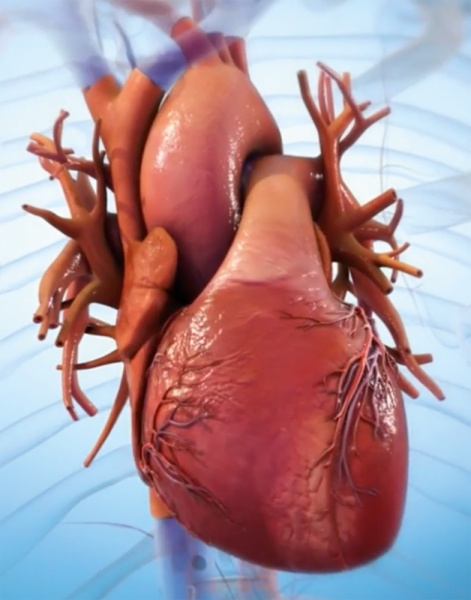
б) 
в) 
г) 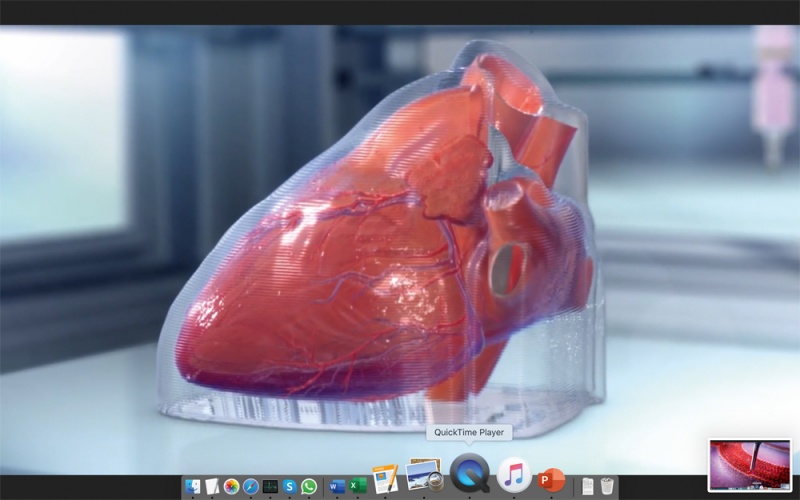
д) 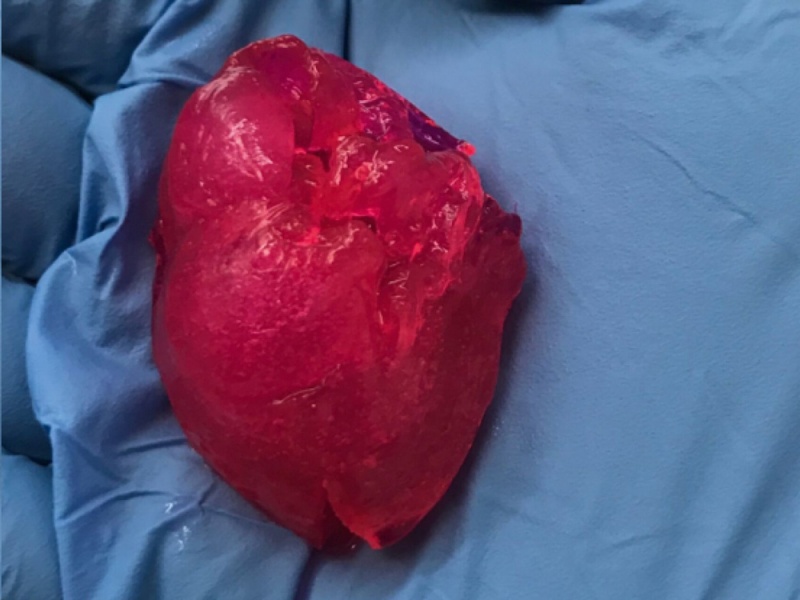
Рис. 4. Процесс печати сердца: a) модель; б) печать слоя; в) выращивание сосудов; г) построенная модель; д) уменьшенное готовое сердце.
Ранее, в 2019 году, компания успешно провела биопечать отдельных компонентов сердца, включая клапаны, желудочки, кровеносные сосуды, а в июне 2018 года она успешно провела биопечать сердечной ткани человека (пластырь сердца).
«Мы продолжим нашу работу до тех пор, пока не сможем печатать полноразмерные сердца, пригодные для трансплантации, и изменим способ лечения болезней сердца навсегда», — сказал Стивен Моррис, генеральный директор компании. Поскольку напечатанные сердца используют клетки пациента, то не возникает проблем с отторжением сердца после трансплантации и существенно ограничивается количество тяжелых для организма восстановительных лекарств, которые пациент должен принимать после пересадки. Моррис добавил, что биопечать сердец также поможет сократить дефицит доступных органов для трансплантации. «Органов просто не хватает всем, кто в них нуждается», — сказал он. По оценкам Центра по контролю и профилактике заболеваний, ежегодно в США от болезней сердца умирает около 610 000 человек.
Биопечать кожи
Кожа является крупнейшим органом тела, она имеет сложную многослойную структуру и защищает мускулы, кости, связки и внутренние органы от любых внешних воздействий. Поэтому важно иметь быстрые и надежные методы регенерации кожи. Производство тканей для замены кожи поможет преодолеть ограничения при традиционных методах работы с повреждениями кожи с точки зрения технологии, затрат времени и средств. Если говорить о работе с поверхностными повреждениями кожи, то технология их лечения с помощью выращенных кожных тканей достаточно хорошо отработана. В то время как опыт лечения глубоких повреждений кожи, особенно ожогов 3 и 4 степеней, с использованием выращенных заменителей кожи пока минимальный [28].
Поэтому перед исследователями стоит задача разработать многослойную архитектуру тканей кожи для выращивания на 3D-биопринтерах, которая будет близка по структуре и своим функциям к натуральной коже.
Появление такой выращенной кожи позволит проводить с ее помощью тестирование лекарственных препаратов и косметики без вовлечения в этот процесс животных.
Материалы для кожи на основе природных гидрогелей: коллаген, желатин, хитозан.
Печать электроники на коже [29]
Исследователи университета Миннесоты представили 3D-печать электроники на реальной руке (рис. 5), а также показали возможность печати клетками для заживления повреждений кожи. Для этих целей используется недорогой 3D-принтер. Технология может применяться в вооруженных силах для печати датчиков радиации, химического заражения и других целей непосредственно в полевых условиях. Принтер допускает небольшие движения руки во время печати, за это отвечает система компьютерного зрения. В качестве чернил используется раствор с чешуйками серебра, который отверждается при комнатной температуре. Напечатанный датчик можно просто смыть водой или убрать пинцетом.

Рис. 5. Пример печати датчика на коже
Создание сосудистой системы для тканевой регенерации
Вместе с созданием структуры ткани необходимо встроить в нее и сосудистую структуру, назначение которой — обеспечивать жизнедеятельность сообщества клеток на время их роста, т. е. снабжать клетки питательными веществами, кислородом, СО2, биомолекулами для управления метаболизмом, ростом популяции клеток, их разделением и определением назначения, а также удалять продукты метаболизма. При этом сосуды диаметром от 4 до 300 мкм, включая капиллярную структуру, должны пронизывать все зоны ткани с размерами 100—200 мкм и более.
Пожалуй, это одна из наиболее сложных задач биопроизводства, несмотря на то, что существует много способов создания сосудистой системы в выращиваемых тканях. Рассмотрим их более подробно.
Выращивание сосудистой структуры in vivo возможно двумя способами: васкулогенезис и ангиогенезис [30], [31]. В первом способе исходные клетки ткани (EPC, endothelial progenitor cells) мигрируют в зоны с недостаточно развитой сетью сосудов, размножаются там и формируют капиллярную систему сосудов. Во втором способе новые кровеносные сосуды прорастают от уже существующих в направлении градиента ангиогенезисного фактора роста (рис. 6).
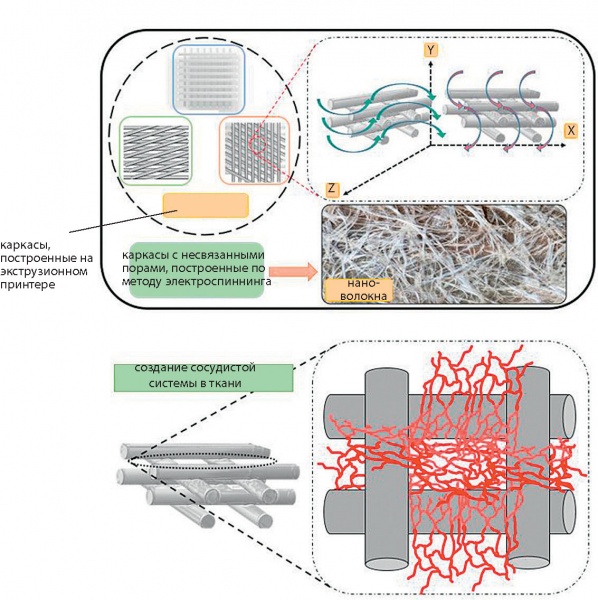 Рис. 6. Каркасы на основе нановолокон (электроспиннинг) и экструзии для выращивания сосудистой системы в тканях
Рис. 6. Каркасы на основе нановолокон (электроспиннинг) и экструзии для выращивания сосудистой системы в тканях
Для построения каркасов (сосудистой структуры) используют АМ-технологии с материалами на основе гидрогелей и биоразлагаемых чернил. Применение экструзионных биопринтеров (ЭБ) с коаксиальными иглами, способных выращивать полые трубки, струйных и лазерных (стереолитография) принтеров позволяет создавать сосудистую структуру с тонкой разветвленной капиллярной архитектурой. 3D-биопечать дает возможность получать более высокие контролируемые концентрации клеток в каркасах.
Примеры выращивания сосудистой структуры in vitro/in vivo с использованием биочернил на основе гидрогелей, биополимеров приведены в ряде работ.
В статье [32] представлен краткий обзор трехмерного биопроизводства сосудистых сетей с помощью ЭБ, лазера, электроспиннинга, укладки микрошаблонов или модулей и методов клеточного листа; обсуждается влияние предваскуляризации на сосудистую сеть, образованную различными методами; преимущества и недостатки различных подходов к изготовлению; предлагаются потенциальные будущие направления исследований.
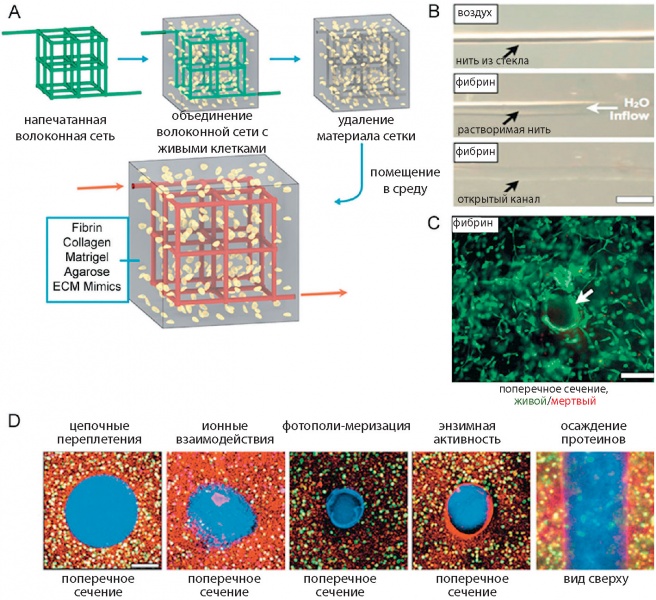 Рис. 7. Печать сосудистой структуры: а) печать объемной сетки сосудов биоразлагаемыми чернилами с клетками; b) удаление материала сетки; c) формирование сосудистой структуры в биореакторе;
Рис. 7. Печать сосудистой структуры: а) печать объемной сетки сосудов биоразлагаемыми чернилами с клетками; b) удаление материала сетки; c) формирование сосудистой структуры в биореакторе;
d) изображения поперечных сечений сосудов в различных гидрогелях
На рис. 8 показаны этапы построения и выращивания сосудистой структуры с помощью экструзионной коаксиальной печати каркасов, на фото поперечного сечения хорошо видны полости сосудов и их стенки [33].
Для печати сосудов применяется экструзионная биопечать с использованием сфероидов без каркасов. После выдержки в биореакторе сфероиды объединяются, образуя одно- или двухслойные трубки микрососудов. Чтобы избежать неоднородности структуры трубок, для печати используют заготовки в виде цилиндрических многоклеточных блоков с коллагеновым гелем в качестве биобумаги для печати. При этом возможно объединение клеток сосудов с элементами коллагена, которые потом непросто удалить из полости сосудов. Чтобы избежать этого, добавляют инертный материал — агарозу, которая замещает коллаген внутри сосудов. Так, например, двухслойные стенки сосудов были сформированы в течение 3 дней после объединения, при этом клетки человека из пупочной вены и фибробласты кожи в виде многоклеточных цилиндрических блоков использовались при послойной печати структуры сосудов в соответствии с их CAD- дизайном [34].
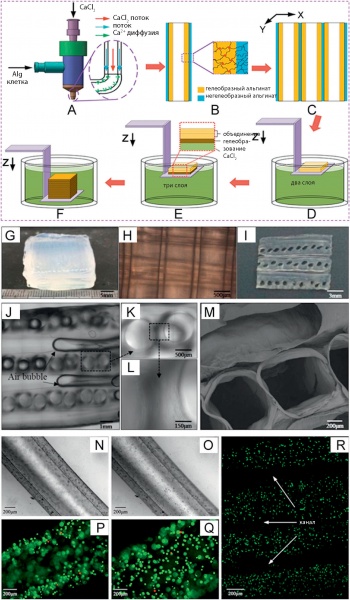 Рис. 8. Стадии роста структуры сосудов
Рис. 8. Стадии роста структуры сосудов
Лазерная 3D-биопечать имеет ряд преимуществ — можно использовать биочернила с высокой вязкостью и печатать с хорошим разрешением и большой точностью. При этом нет проблем с засорением сопел головки, как в других типах 3D-печати. Объемная структура сосудов с использованием лазерной биопечати строится послойно — слой клеток, затем слой гидрогеля и т. д. Ограничения связаны с длительным временем печати, повреждением клеток лазерным излучением, невысокой масштабируемостью [35].
Для создания сосудистой системы можно использовать биопринтеры с фотополимеризацией на основе DLP (отверждение фотополимера за счет засветки УФ-лампой) и на основе лазерной стереолитографии. Хороший результат дает использование лазерного излучения двух и более длин волн. Экспериментально это было показано в работе [36], где трансплантаты демонстрировали хорошую цитосовместимость и их механические свойства были близки к свойствам природных капилляров. На рис. 9 показаны разные способы построения сосудистой структуры в тканях.
Важная задача — выбор подходящих шаблонов из биосовместимых подложек, на которых можно создавать капиллярную структуру, близкую к природным тканям. Различные факторы влияют на формирование капиллярной структуры в тканях, так, например, внеклеточный матрикс (ECM) регулирует морфогенезис капилляров, напряжение сдвига улучшает ангиогенезис, жесткость материала регулирует архитектуру капиллярной сети в растущей ткани. Для формирования шаблонов с микроканалами на биосовместимых подложках используются различные способы: плазменное травление, вырезание лазерным лучом, мягкая литография (А), микропечать (В), точное копирование капиллярной архитектуры живых тканей (рис. 9), [37].
 Рис. 9. Способы построения сосудистой структуры: a) фотополимеризация с использованием маски; b) экструзионная печать; c) микроканалы; d) микросборка за счет использования микрогелей и УФ-засветки
Рис. 9. Способы построения сосудистой структуры: a) фотополимеризация с использованием маски; b) экструзионная печать; c) микроканалы; d) микросборка за счет использования микрогелей и УФ-засветки
В качестве материалов для подложек при построении капиллярной структуры часто применяют искусственные полимеры (силикон, поликарбонат, PVC и другие), но они уступают гидрогелям, которые биосовместимы и имеют высокую степень деградации (это silk fibroin, Matrigel, type I collagen, fibrin — они используются для формирования эндотелиальных трубок в каркасах) [38].
Для формирования крупномасштабных каркасов можно использовать эффект самосборки микромодулей [39], [40], [41]. Специфические клетки ткани инкапсулируются в микромодули, которые защищаются снаружи покрытиями из биоматериалов (протеин, фибронектин и т. д.) и используются в дальнейшем для сборки больших структур. Метод не рекомендуется из-за недостаточной интеграции ткани и капиллярной сети in vivo.
Применение нановолокон для построения сосудистых структур (сополимеров или гибридных — синтетических и природных — биополимеров) обсуждается в работе [42].
При механическом способе создания полых сосудов с помощью стержня из золота, покрываемого клеточными тканями, стержень вводится в среду гидрогеля и после перехода клеток в гель удаляется. Способ не нашел широкого применения из-за невозможности создавать сложные разветвленные структуры сосудов [43].
Биополимеры — способы свободного построения тканей с сосудистой структурой
Полномасштабные конструкты создаваемых тканей, содержащие большие сообщества клеток, требуют соответствующего обеспечения питательными веществами, кислородом, биомолекулами для обслуживания метаболизма, жизнедеятельности и развития клеток. В лабораторных условиях in vitro проблема с обеспечением решается легко. В условиях имплантации ткани в организм in vivo развитие ткани происходит за счет механизмов ангиогенезиса и васкулогенезиса и требует времени. Задержка во времени может вызвать ишемию или некроз тканей. Чтобы избежать этого, рекомендуется использовать заранее подготовленную сеть микрососудов, которые вставляются в имплантаты и позже пришиваются к крупным артериям и венам (рис. 10). Кроме того, для получения устойчивого предсказуемого результата подготовленный конструкт имплантируется сначала в тело донора в область рядом с крупными артериями/венами. После формирования достаточной капиллярной сети каркас эксплантируется из тела донора и имплантируется в предназначенное место пациента. Успешные примеры применения данной технологии описаны в [44].
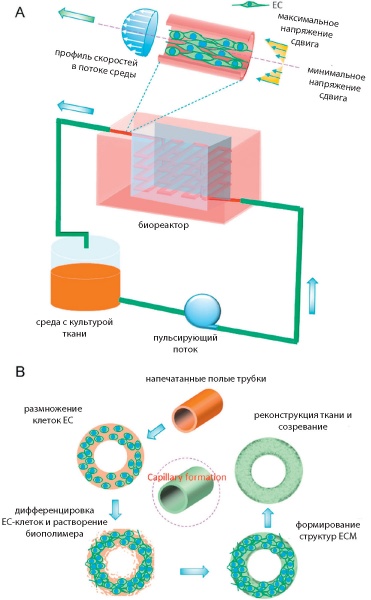 Рис.10. Формирование капилляров в биореакторе
Рис.10. Формирование капилляров в биореакторе
Для обеспечения жизнедеятельности крупноразмерных популяций клеток, встроенных в ткани, необходимо создавать микрокапиллярную структуру. Существует большое количество технологий для создания такой однослойной структуры на плоскости с последующим заселением полостей капилляров эпителиальными клетками: плазменное травление, лазерная нарезка, мягкая литография, создание точных копий природных структур. Обычно объемные капиллярные структуры в ткани создаются наложением множества отдельных слоев, но сложность и длительность такой сборки ограничивают это применение. Есть другое решение, когда плоские капиллярные структуры за счет управляемых (циркуляция среды, распределение биомолекул, вязкость) микропотоков жидкости, содержащей клетки EC и материала стенки сосудов, встраиваются на поверхности полых структур ткани изнутри. Затем такие микромодули, содержащие специфические клетки ткани, помещаются в напечатанные ткани и отправляются для дальнейшего выращивания в биореактор.

Этот способ также имеет свои ограничения, связанные с невозможностью получить аналог природных капиллярных структур, а также с плохой интеграцией полученной структуры с тканями.
Интересным решением представляется построение объемной структуры микро- и макрососудов, близкой к природной, с использованием нановолокон для биопечатных структур, в которые высеваются клетки.
Рассматривалась также идея изготавливать сосудистую структуру для тканей, используя матрицы природных тканей, из которых удаляются клетки, но остается биологическая и физическая структура ткани, и в нее высеваются нужные клетки для выращивания капиллярной структуры. Практической реализации данный метод не нашел из-за сложностей подготовки исходных структур и иммунологических проблем.
Наиболее успешные результаты в формировании сосудистой структуры дает использование бескаркасного подхода, а именно применение микрошаблонов, напечатанных с помощью тканевых волокон, в которые высевались клеточные агрегаты и деградирующий материал. Многочисленные опыты показали успешное выращивание капиллярной структуры в полномасштабных тканях при использовании тонких листовых клеточных шаблонов. Проблемы остаются пока с механической стабильностью таких структур, обладающих свойствами самосборки.
Будущие успехи в создании тканей с встроенной капиллярной структурой требуют создания новой конструкции биореакторов, биокультур и условий развития в биореакторах, высевания клеток, организации микропотоков жидкостей и, естественно, отработку на многочисленных хирургических операциях. Ожидается, что совместное применение струйной печати и биоплоттера в итоге приведет к решению задачи одновременной печати клеточных агрегатов, тканевых волокон и капиллярной сети, что даст возможность формировать сложные тканевые структуры с капиллярной структурой, а также готовые органы. ■
Литература
- Z. Shi, X. Gao, M. W. Ullah, S. Li, Q. Wang, G. Yang, et al. Electroconductive natural polymer-based hydrogels, Biomaterials, 111 (2016), Рp. 40—54.
- Construction of 3D in vitro models by bioprinting human pluripotent stem cells: Challenges and opportunities Federico Salaris, Alessandro Rosa. Brain Research Volume 1723, 15 November 2019, 146393.
- Reid et al., 2016 J. A. Reid, P. A. Mollica, G. D. Johnson, R. C. Ogle, R. D. Bruno, P. C. Sachs Accessible bioprinting: adaptation of a low-cost 3D-printer for precise cell placement and stem cell differentiation. Biofabrication, 8 (2016), Article 025017.
- Q. Gu, E. Tomaskovic-Crook, R. Lozano, Y. Chen, R. M. Kapsa, Q. Zhou, G. G. Wallace, J. M. Crook Functional 3D neural mini-tissues from printed gel-based bioink and human neural stem cells Adv. Healthc. Mater., 5 (2016), Рp. 1429—1438.
- D. Nguyen, D. A. Hägg, A. Forsman, J. Ekholm, P. Nimkingratana, C. Brantsing, T. Kalogeropoulos, S. Zaunz, S. Concaro, M. Brittberg, A. Lindahl, P. Gatenholm, A. Enejder, S. Simonsson Cartilage tissue engineering by the 3D bioprinting of iPS cells in a nanocellulose/alginate bioink. Sci. Rep., 7 (2017), Р. 658.
- L. Koch, A. Deiwick, A. Franke, K. Schwanke, A. Haverich, R. Zweigerdt, B. Chichkov Laser bioprinting of human induced pluripotent stem cells-the effect of printing and biomaterials on cell survival, pluripotency, and differentiation. Biofabrication, 10 (2018), Article 035005.
- A. Faulkner-Jones, C. Fyfe, D. — J. Cornelissen, J. Gardner, J. King, A. Courtney, W. Shu. Bioprinting of human pluripotent stem cells and their directed differentiation into hepatocyte-like cells for the generation of mini-livers in 3D. Biofabrication, 7 (2015), Article 044102.
- X. Ma, X. Qu, W. Zhu, Y. — S. Li, S. Yuan, H. Zhang, J. Liu, P. Wang, C.S.E. Lai, F. Zanella, G. — S. Feng, F. Sheikh, S. Chien, S. Chen Deterministically patterned biomimetic human iPSC-derived hepatic model via rapid 3D bioprinting. Proc. Natl. Acad. Sci. U.S.A., 113 (2016), Рp. 2206—2211.
- C. Yu, X. Ma, W. Zhu, P. Wang, K. L. Miller, J. Stupin, A. Koroleva- Maharajh, A. Hairabedian, S. Chen Scanningless and continuous 3D bioprinting of human tissues with decellularized extracellular matrix. Biomaterials, 194 (2019), Рp. 1—13.
- C. S. Ong, T. Fukunishi, A. Nashed, A. Blazeski, H. Zhang, S. Hardy, D. DiSilvestre, L. Vricella, J. Conte, L. Tung, G. Tomaselli, N. Hibino Creation of cardiac tissue exhibiting mechanical integration of spheroids using 3D bioprinting. J. Vis. Exp. (2017).
- C. S. Ong, T. Fukunishi, H. Zhang, C. Y. Huang, A. Nashed, A. Blazeski, D. DiSilvestre, L. Vricella, J. Conte, L. Tung, G. F. Tomaselli, N. Hibino Biomaterial-free three-dimensional bioprinting of cardiac tissue using human induced pluripotent stem cell derived cardiomyocytes Sci. Rep., 7 (2017), p. 4566.
- L. Moldovan, A. Barnard, C.-H. Gil, Y. Lin, M.B. Grant, M.C. Yoder, N. Prasain, N.I. Moldovan iPSC-derived vascular cell spheroids as building blocks for scaffold-free biofabrication Biotechnol. J., 12 (2017).
- A. Sorkio, L. Koch, L. Koivusalo, A. Deiwick, S. Miettinen, B. Chichkov, H. Skottman Human stem cell based corneal tissue mimicking structures using laser- assisted 3D bioprinting and functional bioinks. Biomaterials, 171 (2018), Рp. 57-71.
- 3D bioprinting of liver spheroids derived from human induced pluripotent stem cells sustain liver function and viability in vitro”, Goulart E1, de Caires-Junior LC, Telles-Silva KA, Araujo BHS, Rocco SA, Sforca M, de Sousa IL, Kobayashi GS, Musso CM, Assoni AF, Oliveira D, Caldini E, Raia S, Lelkes PI, Zatz M. Biofabrication. 2019 Nov 27; 12(1): 015010. doi: 10.1088/1758-5090/ab4a30.
- Regeneration of diaphragm with bio-3D cellular patch Xiu-Ying Zhang, Yusuke Yanagi, Zijing Sheng, Kouji Nagata, Koichi Nakayama, Tomoaki Taguchi. Biomaterials, Volume 167, June 2018, Рp. 1-14.
- M. Itoh, K. Nakayama, R. Noguchi, K. Kamohara, K. Furukawa Scaffold-free tubular tissues created by a Bio-3D printer undergo remodeling and endothelialization when implanted in rat aortae. PLoS One, 10 (2015), Рp. 1-15.
- Y. Yanagi, K. Nakayama, T. Taguchi, S. Enosawa, T. Tamura, K. Yoshimaru, T. Matsuura, M. Hayashida, K. Kohashi, Y. Oda, T. Yamaza, E. Kobayashi In vivo and ex vivo methods of growing a liver bud through tissue connection. Sci. Rep., 7 (2017), Р. 14085.
- 3D Printing of Personalized Thick and Perfusable Cardiac Patches and Hearts Nadav Noor, Assaf Shapira ... See all authors. Advanced Science / Volume 6, Issue 11 First published: 15 April 2019. https://doi.org/10.1002/advs.201900344
- Biomaterial-Free Three-Dimensional Bioprinting of Cardiac Tissue using Human Induced Pluripotent Stem Cell Derived Cardiomyocytes. Chin Siang Ong, Takuma Fukunishi, Huaitao Zhang, Chen Yu Huang, Andrew Nashed, Adriana Blazeski, Deborah DiSilvestre, Luca Vricella, John Conte, Leslie Tung, Gordon F. Tomaselli & Narutoshi Hibino. Scientific Reports, volume 7, Article number: 4566 (2017).
- Human stem cell based corneal tissue mimicking structures using laser-assisted 3D bioprinting and functional bioinks. Sorkio A., Koch L., Koivusalo L., Deiwick A., Miettinen S., Chichkov B., Skottman H. Biomaterials. 2018 Jul;171:57-71. doi: 10.1016/j.biomaterials.2018.04.034
- Potential of 3D-printed models in planning structural interventional procedures. G. Gómez-Ciriza, T. Hussain, T. Gómez-Cía, I. Valverde. Inter Cardiol, 7 (2015), Рp. 1-5.
- 3D heart model printing for preparation of percutaneous structural interventions: description of the technology and case report. R. Dankowski, A. Baszko, M. Sutherland, et al. Kardiol Pol, 72 (6) (2014), Рp. 546-551.
- A. Haleem, M. Javaid 3D scanning applications in medical field: a literature-based review. Clin Epidemiol Global Health (2018), 10.1016/j.cegh.2018.05.006
- N.S. Birbara, J.M. Otton, N. Pather 3D modelling and printing technology to 3 produce patient-specific 3D models. Heart Lung Circulation (2017), 10.1016/j.hlc.2017.10.017
- K. Hadeed, P. Acar, Y. Dulac, F. Cuttone, X. Alacoque, C. Karsenty Cardiac 3D printing for better understanding of congenital heart disease Arch Cardiovasc Disease, 111 (2018), Рp. 1-4.
- TAU scientists print first ever 3D heart using patient’s own cells. https://english.tau.ac.il/news/printed_heart
- BIOLIFE4D CEO Says Firm ‘One Step Closer’ to 3D Printing a Viable Human Heart. October 10, 2019. https://biolife4d.com
- Vijayavenkataraman, S.; Lu, W.F.; Fuh, J.Y. 3D bioprinting of skin: A state-of-the-art review on modelling, materials, and processes. Biofabrication 2016, 8, 032001.
- Zhu Z, Guo SZ, Hirdler T et al. 3D Printed Functional and Biological Materials on Moving Freeform Surfaces. https://doi.org/10.1002/adma.201707495 (2018).
- Colosi et al., 2017 C. Colosi, M. Costantini, A. Barbetta, M. Dentini Microfluidic bioprinting of heterogeneous 3D tissue constructs. Methods Mol. Biol., 1612 (2017), Рp. 369-380.
- Chimene, D.; Lennox, K.K.; Kaunas, R.R.; Gaharwar, A.K. Advanced bioinks for 3D printing: A materials science perspective. Ann. Biomed. Eng. 2016, 44, 2090.
- 3D biofabrication of vascular networks for tissue regeneration: A report on recent advances. M.D. Sarker , Saman Naghieh , N.K. Sharma , Xiongbiao Chen. Journal of Pharmaceutical Analysis Volume 8, Issue 5, October 2018, pp. 277-296. www.sciencedirect.com/science/article/pii/S2095177918300911?via%3Dihub
- Q. Gao, Y. He, J.Z. Fu, et al. Coaxial nozzle-assisted 3D bioprinting with built-in microchannels for nutrients delivery. Biomaterials, 61 (2015), Рp. 203-215.
- C. Norotte, F.S. Marga, L.E. Niklason, et al. Scaffold-free vascular tissue engineering using bioprinting. Biomaterials, 30 (2009), Рp. 5910-5917.
- M.B. Applegate, J. Coburn, B.P. Partlow, et al. Laser-based three-dimensional multiscale micropatterning of biocompatible hydrogels for customized tissue engineering scaffolds. Proc. Natl. Acad. Sci. USA, 112 (2015), Рp. 12052-12057.
- W. Meyer, S. Engelhardt, E. Novosel, et al. Soft polymers for building up small and smallest blood supplying systems by stereolithography J. Funct. Biomater., 3 (2012), Рp. 257-268.
- C.W. Peak, L. Cross, A. Singh, et al. Microscale technologies for engineering complex tissue structures. Microscale Technol. Cell Eng., Springer (2016), Рp. 3-25.
- B.M. Baker, B. Trappmann, S.C. Stapleton, et al. Microfluidics embedded within extracellular matrix to define vascular architectures and pattern diffusive gradients Lab Chip, 13 (2013), Рp. 3246-3252.
- Pati F, SongT, Rijal G, JangJ, Won S, et al. (2014) Ornamenting 3D printed scaffolds with cell-laid extracellular matrix for bone tissue regeneration. Biomaterials 37: 230-240. http://bit.ly/2RSVJz3
- J.M. Kelm, V. Djonov, L.M. Ittner, et al. Design of custom-shaped vascularized tissues using microtissue spheroids as minimal building units.Tissue Eng., 12 (2006), Рp. 2151-2160.
- KyoungHo Lee GK, Jin GH, Jang CH (2013) Preparation and characterization of multi-layered poly(-caprolactone)/chitosan scaffolds fabricated with a combination of melt-plotting/in situ plasma treatment and a coating method for hard tissue regeneration. J Mater Chem B 1: 5831–5841. https://rsc.li/2XKB859.
- L. Ghasemi-Mobarakeh, M.P. Prabhakaran, M. Morshed, et al. Electrospun poly (-caprolactone)/gelatin nanofibrous scaffolds for nerve tissue engineering. Biomaterials, 29 (2008), Рp. 4532-4539.
- N. Sadr, M. Zhu, T. Osaki, et al. SAM-based cell transfer to photopatterned hydrogels for microengineering vascular-like structures. Biomaterials, 32 (2011), Рp. 7479-7490.
- T. Dvir, A. Kedem, E. Ruvinov, et al. Prevascularization of cardiac patch on the omentum improves its therapeutic outcome. Proc. Natl. Acad. Sci. USA, 106 (2009), Рp. 14990-14995.

Автор: Николай Михайлович Максимов
Источник журнал "Аддитивные технологии" № 3-2020



