Использование разработанной технологии создания импантатов позволяет прецизионно и одномоментно заместить костные дефекты любой формы, сложности и размеров, упростить технику операции.
ВВЕДЕНИЕ
Одной из актуальных проблем современной медицины является лечение пациентов с костной онкопатологией. Рост заболеваемости как первичными опухолями, так и метастатическими поражениями костно-мышечной системы человека с каждым годом возрастает. Ежегодно диагностируется более 2900 случаев впервые выявленных остеогенных сарком [1-3]. Кроме того, в кости метастазируют многие злокачественные заболевания. Поражение скелета выявляется у 65-73 % больных карциномой молочной железы, у 56-68 % аденокарциномой простаты и у 30-36 % раком легкого [4, 5]. Чаще всего (от 40 до 70 % случаев) опухоли костной системы локализуются в длинных трубчатых костях [6]. В структуре поражений костей верхней конечности наиболее часто опухолевые очаги располагаются в проксимальном отделе (более 40 % случаев) и диафизе (около 15 % случаев) плечевой кости, дистальном отделе лучевой кости (около 20 % случаев) [2]. Первичные опухоли и метастатические очаги опорно-двигательного аппарата значительно ухудшают качество жизни больного, приводят к его инвали-дизации, а в ряде случаев, и к летальному исходу [7]. Смертность только от патологических переломов достигает 32 % случаев [8]. Основным методом лечения опухолей костей является хирургический. Однолетняя выживаемость пациентов с множественными метастазами в кости без оперативного пособия составляет всего 8-13 % [6, 9].
До семидесятых годов прошлого столетия при костной онкопатологии конечностей выполнялись в большинстве случаев ампутации. Сейчас наиболее приоритетными в лечении пациентов с данной патологией являются органосохранные операции, включающие удаление новообразования и пластику образующегося дефекта аутокостью или имплантатами из синтетических материалов [4, 10, 11]. Применение технологий трехмерной печати в производстве имплантатов обеспечивает их высокую прецизионность и персонифицированность, возможность создания любой формы, сложности и размеров [12, 13, 16, 17].
ЦЕЛЬ ИССЛЕДОВАНИЯ - ОЦЕНИТЬ РЕЗУЛЬТАТЫ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ПАЦИЕНТОВ С ОНКОПАТОЛОГИЕЙ ДЛИННЫХ ТРУБЧАТЫХ КОСТЕЙ ВЕРХНИХ КОНЕЧНОСТЕЙ С ИСПОЛЬЗОВАНИЕМ ОДНОМОМЕНТНОЙ КОСТНОЙ ПЛАСТИКИ ОБРАЗОВАВШИХСЯ ДЕФЕКТОВ ИНДИВИДУАЛЬНЫМИ ИМПЛАНТАТАМИ ИЗ КОСТНОЗАМЕЩАЮЩЕГО ВЕЩЕСТВА, ИЗГОТОВЛЕННЫМИ С ПРИМЕНЕНИЕМ ТЕХНОЛОГИЙ ТРЕХМЕРНОЙ ПЕЧАТИ
МАТЕРИАЛЫ И МЕТОДЫ
Проведено клинико-рентгенологическое обследование 22 пациентов с онкопатологией костей верхних конечностей после хирургического лечения, которое включало удаление новообразования и одномоментную костную пластику индивидульным имплантатом, изготовленным с помощью трехмерной печати. В группе было 10 мужчин (возраст - 44,5 ± 3,8 года, 95 % доверительный интервал: 41-49) и 12 женщин (возраст - 56,3 ± 4,2 года, 95 % доверительный интервал: 51-62). Патологический очаг у 11 пациентов находился в плечевой кости, у 7 - в лучевой, у 4 - в локтевой. Доброкачественные новообразования были у 13 (59 %) пациентов, злокачественные у 9 (41 %). Все пациенты с доброкачественными опухолями предъявляли жалобы на боли, нарушение функции верхней конечности. Всем больным со злокачественными новообразованиями на догоспитальном этапе был проведен курс лучевой и химиотерапии, диагноз был подтвержден гистологическим и иммуногистохимическим исследованием материала после открытой биопсии.
После верификации диагноза производили удаление опухоли с последующим замещением образовавшегося дефекта костной ткани индивидуальным имплантатом, изготовленным по разработанной технологии [14]. Для этого по данным компьютерной томографии пациента создавали виртуальную 3D модель поврежденного сегмента с установкой по шкале Хаунсфилда параметров (0-250), характерных для костных структур. Затем с помощью стандартных инструментов для компьютерного моделирования производили удаление опухоли в пределах здоровых тканей (рис. 1).
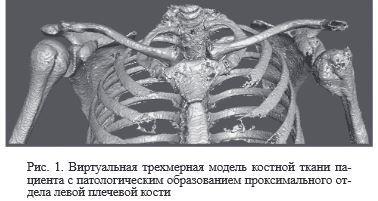
После этого производили реконструкцию отсутствующих участков костной ткани c созданием виртуальной 3D модели имплантата, используя методики топологической оптимизации и гибридного параметрического моделирования (рис. 2).
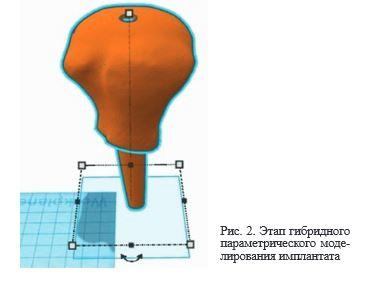
Затем на основе полученных данных о трехмерной структуре имплантата создавали виртуальную модель матрицы, которая использовалась в последующем для его изготовления из костнозамещающего материала. После этого ее отправляли (через USB кабель) на FDM 3D принтер для производства (рис. 3, 4).

По завершении трехмерной печати в созданную матрицу импактировали в жидком виде костнозамещающее вещество. Когда оно отвердевало, матрицу разбирали. В результате чего оставался имплантат, который после стерилизации передавали в операционную.
При обширных дефектах (более 5 см2) вместе с костнозамещающим материалом использовалась измельченная аллокость, изготавливаемая по стандартным методикам из аллотрансплантатов, применяемых в учреждении. По показаниям производился остеосинтез металлоконструкциями с целью армирования поврежденного участка костной ткани и предотвращения переломов в послеоперационном периоде. Для этого применялись погружные имплантаты - пластины, интрамедуллярные стержни. Радикальность удаления новообразования проверялась с использованием экспресс-исследования тканей с концов опила.
При создании индивидуальных имплантатов использовался костный цемент (полиметилметакрилат) или разработанное с участием ФГБУ «Приволжский федеральный медицинский исследовательский центр» костнозамещающее вещество «Рекост» [15]. Выбор материала для изготовления имплантата осуществлялся рандомизированно с применением методики «четных и нечетных номеров историй болезни» (табл. 1, 2).
При клиническом обследовании пациентов использовались следующие опросники: «The Short Form-36» [18], «Musculoskeletal Tumor Society» (MSTS) [19] и «Visual analog scale» (VAS) [20].
Обследование всех пациентов производилось до операции и на контрольном осмотре через 1 год после нее.
Исследование выполнено в соответствии с этическими принципами, предъявляемыми Хельсинкской Декларацией Всемирной Медицинской Ассоциации (World Medical Association Declaration of Helsinki(1964, 2011 - поправки)) и "Правилами клинической практики в Российской Федерации", утвержденными Приказом Минздрава РФ от 19.06.2003 г. № 266.
Статистическая оценка данных выполнялась с помощью программы Statistica 6.1. Результаты представлены в виде М ± о, где М - среднее арифметическое, о - стандартное отклонение. Оценка достоверности различий между группами проводилась с помощью U-критерия Манна-Уитни. За достоверные данные принимали отличия при уровне вероятности p < 0,05.
РЕЗУЛЬТАТЫ
При обследовании пациентов через 1 год после оперативного лечения у всех отмечалась положительная динамика в виде уменьшения интенсивности или отсутствия болевого синдрома, увеличения объема движений в суставах поврежденной верхней конечности, улучшения качества их жизни.
Пациенты, которым выполнялось оперативное лечение злокачественных новообразований, вернулись к обычной жизни и трудовой деятельности в 44 % случаев (4 больных).
Частичное восстановление функции верхних конечностей наблюдалось у 5 (56 %) пациентов. После проведенного анкетирования пациентов с использованием «The Short Form-36»
ставили 18,4 ± 2,1 балла (до операции 4,9 ± 1,7 балла), «Mental Health» - 20,9 ± 2,3 балла (до операции 5.3 ± 2,2 балла).
По результатам обследования пациентов с доброкачественными опухолями по «The Short Form-36» общие показатели составили для «Physical Functioning» 30.3 ± 7,4 балла (до операции 11,6 ± 2,9 балла), для «Mental Health» - 40,7 ± 6,2 балла (до операции 16,5 ± 3,3 балла). Вернуться к обычной жизни и трудовой деятельности смогли все пациенты.
Статистически значимое (p < 0,05) улучшение показателей после оперативного лечения во всех группах наблюдалось также по результатам анкетирования пациентов по «VAS», «MSTS» (табл. 3).
Для проверки гипотезы об улучшении показателей по всем шкалам после оперативного лечения использовался U-критерий Манна-Уитни. В группе в целом и в подгруппах, сформированных по используемому материалу для создания имплантатов, получен статистически значимый прирост показателей по «MSTS», «The Short Form-36» и снижение по «VAS» (p < 0,05). При сравнении подгрупп статистически значимых различий в зависимости от используемого материала получено не было (p > 0,05).
По данным рентгенографии верхних конечностей у пациентов в отдаленном послеоперационном периоде миграции имплантатов диагностировано не было. По данным компьютерной-томографии выявлено наличие краевой остеоинтеграции у 4 (36 %) пациентов, которым было выполнено замещение дефектов с использованием имплантата из разработанного костнозамещающего материала «Рекост». Из них у двух выполнялась операция по поводу энходромы, у одного - костной кисты, у одного - метастаза рака молочной железы.
Для демонстрации результатов оперативного лечения онкопатологии верхних конечностей с использованием персонифицированных имплантатов из костезамещающего вещества, созданных по разработанной технологии, приводится два клинических примера.
Клинический пример № 1. Пациент К., 58 лет. Диагноз: метастатическое поражение правой плечевой кости в верхней трети. Аденокарционома простаты. Жалобы на боль, нарушение функции правой верхней конечности. Объем движений в правом плечевом суставе: экстензия/флексия - 5°/0°/30°, абдукция/аддукция -30°/0°/10°, ротация кнаружи / ротация кнутри - 5°/0°/10°. Результаты обследования пациента до операции с использованием опросников: «VAS» - 8 баллов, «The Short Form-36» - 38 баллов, «MSTS» - 25 %. По данным рентгенографии выявлено наличие патологического образования в верхней трети правой плечевой кости (рис. 5).
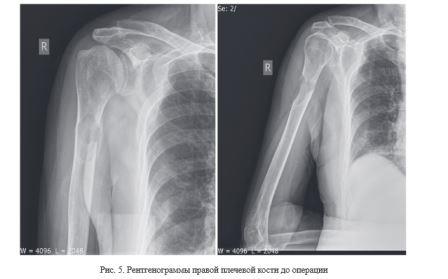
Выполнена сегментарная резекция патологического очага с последующей костной пластикой образовавшегося дефекта индивидуальным имплантатом из костного цемента и фиксацией интрамедулярным стежнем UHN (рис. 6).
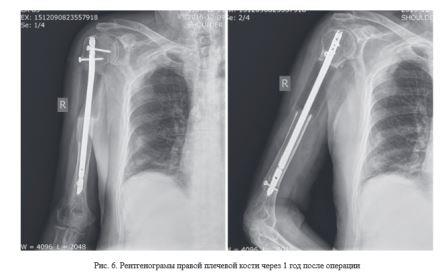
Послеоперационный период протекал без осложнений. Контрольное обследование произведено через 1 год после операции. При анкетировании по «VAS» - 3 балла, «The Short Form-36» - 70 баллов, «MSTS» - 75 %. Объем движений в правом плечевом суставе: экстензия/ флексия - 5°/0°/90°, абдукция/аддукция - 70°/0°/20°, ротация кнаружи/ротация кнутри - 20°/0°/20°.
Клинический пример № 2. Пациентка Б., 55 лет. Диагноз: патологический перелом левого плеча. Метастаз рака правой молочной железы. Жалобы при поступлении на боль, нарушение функции левой верхней конечности. Травмы в анамнезе не было. Результаты анкетирования пациентки до операции: «VAS» - 8 баллов, «The Short Form-36» - 39 баллов, «MSTS» - 15 %. Движения в левом плечевом суставе невозможны из-за выраженного болевого синдрома. По данным рентгенографии - наличие патологического перелома на границе верхней и средней трети диафиза левой плечевой кости (рис. 7).
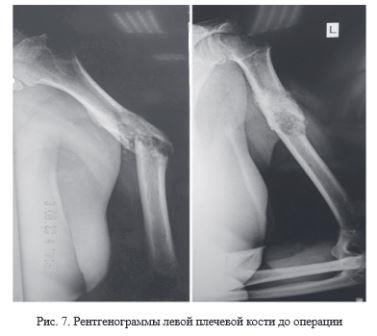
Выполнено удаление патологического очага с последующей костной пластикой дефекта индивидуальным имплантатом из костнозамещающего вещества «Рекост», который является рентгенонегативным. Для фиксации использовался интрамедуллярный стержень UHN (рис. 8).
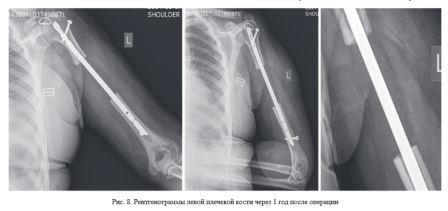
Послеоперационный период протекал без осложнений. На контрольном осмотре пациентки через 1 год после операции: «VAS» - 3 балла, «The Short Form-36» - 71 балл, «MSTS» - 67 %. Объем движений в левом плечевом суставе: экстензия/флексия - 5°/0°/80°
ДИСКУССИЯ
Одной из актуальных проблем лечения костной онкопатологии явлется замещение образовавшегося после удаления опухоли дефекта. Применение с этой целью аутотрансплантатов имеет следующие недостатки: необходимость интраоперационного моделирования, ограниченность в объеме трансплантата, травматизация донорского участка. Применение ксено- и аллотрансплантатов обусловливает необходимость наличия костного банка с его постоянным пополнением, высокую вероятность развития гистонесовместимости тканей. Также при их использовании частота несращений достигает 33 %. Кроме того, при применении биологических трансплантатов необходима длительная иммобилизация, и отсутствует возможность раннего функционального лечения [1, 3, 21-23]. Также используются онкологические эндопротезы, применение которых сопряжено с высоким риском развития асептической нестабильности и некротических процессов в месте контакта с костью, необходимостью в ревизионных оперативных вмешательствах [22, 24]. Имеющиеся методики и технологии изготовления имплантатов не обеспечивают возможность их моделирования и топологической адаптации с прецизионным соответствием физическим и объемным параметрам замещаемого дефекта, создание их из костнозамещающего материала для оперативного лечения костной онкопатологии с поражением крупного сегмента конечности [16, 17]. Использование разработанной технологии в создании индивидуальных имплантатов позволило избежать этих недостатков.
Применение матриц в производстве имплантатов из костного цемента обеспечило отсутствие термического повреждения костной ткани пациента, которое возникает при застывании данного материала.
Учитывая отсутствие статистически достоверных различий при оценке клинических результатов лечения пациентов с применением имлантатов из костного цемента и разработанного костнозамещающего вещества, наличие краевой остеоинтеграции у 4 (36 %) человек, мы считаем, что «Рекост» может являться приоритетным в выборе материала для создания индивидуальных имплантатов.
Отсутствие рентгенологических признаков миграции имплантатов, по нашему мнению, обусловлено не только стабильной фиксацией металлоконструкциями, но и эластичной компрессией костной тканью пациента, благодаря разработанной технологии изготовления имплантатов, позволяющих прецизионно заместить костный дефект.
ЗАКЛЮЧЕНИЕ
Использование персонифицированных имплантатов, создаваемых с применением трехмерной печати по разработанной технологии, позволяет прецизионно и одномоментно заместить костные дефекты любой формы, сложности и размеров, возникающие после удаления опухоли, упростить технику оперативного вмешательства. Применение матриц обеспечивает возможность создания имплантатов из любых костезамещающих материалов, имеющих жидкую стадию в процессе затвердевания, позволяет избежать термического повреждения тканей организма костным цементом. У всех пациентов после оперативного лечения отмечалась положительная динамика в виде уменьшения интенсивности или полного отсутствия болевого синдрома, улучшения показателей по результатам анкетирования по «MSTS», «The Short Form-36» и «VAS». Хирургическое лечение больных с онкопатологией плечевой, локтевой и лучевой костей с использованием одномоментной костной пластики образовавшихся дефектов индивидуальными имплантатами из костнозамещающего вещества, изготовленными с применением технологий трехмерной печати, является одним из эффективных методов улучшения функции пораженной верхней конечности и качества жизни пациентов.
ЛИТЕРАТУРА
1. Алиев М.Д., Сушенцов Е.А. Современная онкоортопедия // Саркомы костей, мягких тканей и опухоли кожи. 2012. № 4. С. 3-10.
2. Вырва О.Е., Бурлака В.В., Михановский Д.А. Индивидуальное эндопротезирование при лечении злокачественных опухолей костей верхней конечности // Ортопедия, травматология и протезирование. 2011. № 2. С. 71-75.
3. Семинар по костной патологии. Классическая остеосаркома. Новое или хорошо забытое старое? / Д.В. Рогожин, И.В. Булычева, Н.Е. Куш-линский, Ю.Н. Соловьев, F. Bertoni, P Bacchini, А.Н. Казакова // Саркомы костей, мягких тканей и опухоли кожи. 2014. № 2. С. 9-18.
4. Карпенко В.Ю., Державин В.А., Бухаров А.В. Эндопротезирование плечевого сустава при опухолевом поражении проксимального отдела плечевой кости // Исследования и практика в медицине. 2015. Т. 2, № 2. С. 15-23.
5. Усманова Е.Б., Сушенцов Е.А., Щелкова О.Ю. Качество жизни пациентов с опухолями костей // Саркомы костей, мягких тканей и опухоли кожи. 2015. № 1. С. 55-61.
6. Специализированная помощь больным со злокачественными и доброкачественными опухолями костей скелета. 10-летний анализ по материалам Казахского НИИ онкологии и радиологии / ГА. Серикбаев, Ж.О. Мауленов, Д.А. Тулеуова, А.К. Курманалиев, ГС. Ахметова // Саркомы костей, мягких тканей и опухоли кожи. 2015. № 4. С. 36-41.
7. Балаев П.И., Люлин С.В., Мещерягина И.А. Малоинвазивные хирургические вмешательства в лечении больных с метастатическим поражением позвоночника // Саркомы костей, мягких тканей и опухоли кожи. 2016. № 3. С. 22-26.
8. Радченко А.И., Жуковец А.Г, Богдаев Ю.М. Результаты хирургического лечения патологических переломов длинных трубчатых костей у пациенток, страдающих раком молочной железы // Саркомы костей, мягких тканей и опухоли кожи. 2016. № 3. С. 11-14.
9. Тепляков В.В., Алиев М.Д. Руководство по онкологии / под ред. В.И. Чиссова, С.Л. Дарьяловой. М., 2008. С. 680-693.
10. Опыт эндопротезирования крупных суставов при опухолях костей в Самарской области / ГП. Котельников, А.Е. Орлов, В.В. Стадлер, РВ. Хобта, Д.А. Огурцов, В.В. Иванов, А.Н. Николаенко, С.А. Приходько // Саркомы костей, мягких тканей и опухоли кожи. 2016. № 2. С. 11-16.
11. Остеобластома / А.Б. Блудов, А.В. Федорова, Я.А. Щипахина, А.С. Неред, Н.В. Кочергина // Саркомы костей, мягких тканей и опухоли кожи. 2015. № 4. С. 20-30.
12. Карякин Н.Н., Горбатов РО. Прецизионные персонифицированные направители для эндопротезирования коленного сустава // Современные проблемы науки и образования. 2016. № 5. С. 23-31.
13. Возможности улучшения функции и косметики культей пальцев кисти методом оссеоинтеграции /А.А. Корюков, А.В. Губин, В.П. Кузнецов, Д.Ю. Борзунов, А.В. Антипов, Е.Н. Овчинников, А.В. Резник, А.А. Еманов, О.Н. Владимирова // Гений ортопедии. 2016. N° 4. С. 22-28.
14. Способ изготовления индивидуализированного прецизионного биоимпланта для одномоментного замещения костных дефектов: пат. 2598769 Рос. Федерация. № 2015130372/14 ; заявл. 22.07.15 ; опубл. 27.09.16, Бюл. № 27. 5 с.
15. Костнозамещающий материал: пат. 2518753 Рос. Федерация. № 2012152201/15 ; заявл. 04.12.12 ; опубл. 10.06.14, Бюл. № 16. 9 с.
16. One-step reconstruction with a 3D-printed, biomechanically evaluated custom implant after complex pelvic tumor resection / K.C. Wong,
S.M. Kumta, N.V. Geel, J. Demol // Comput. Aided Surg. 2015. Vol. 20, No 1. P14-23. doi: 10.3109/10929088.2015.1076039.
17. Reconstruction of the upper cervical spine using a personalized 3D-printed vertebral body in an adolescent with Ewing sarcoma / N. Xu, F. Wei, X. Liu, L. Jiang, H. Cai, Z. Li, M. Yu, F. Wu, Z. Liu // Spine. 2016. Vol. 41, No 1. P. E50-E54. doi: 10.1097/BRS.0000000000001179.
18. Ware J.E. SF-36 physical and mental health summary scales: a user's manual. Boston: Health Institute, New England Medical Center, 1994.
19. Enneking W.F., Spanier S.S., Goodman M.A. A system for the surgical staging of musculoskeletal sarcoma // Clin. Orthop. Relat. Res. 1980. No 153. P 106-120.
20. Comparison of fixed interval and visual analogue scales for rating chronic pain / C.R. Joyce, D.W. Zutshi, V. Hrubes, R.M. Mason // Eur. J. Clin. Pharmacol. 1975. Vol. 8, No 6. P 415-420.
21. The use of bone graft substitutes in large cancellous voids: any specific needs? / O. Faour, R. Dimitriou, C.A. Cousins, PV. Giannoudis // Injury. 2011. Vol. 42, Suppl. 2. P S87-S90. doi: 10.1016/j.injury.2011.06.020.
22. Gosal G.S., Boparai A., Makkar G.S. Long-term outcome of endoprosthetic replacement for proximal femur giant cell tumor // Niger. J. Surg. 2015. Vol. 21, No 2. P. 143-145. doi: 10.4103/1117-6806.162583.
23. Reconstruction using massive allografts after resection of extremity osteosarcomas the study design: A retrospective cohort study / G. Han, Y. Wang, W. Bi, J. Jia, W. Wang, M. Xu, X. Zheng, L. Mei, M. Yang // Int. J. Surg. 2015. Vol. 21. P. 108-111. doi: 10.1016/j.ijsu.2015.07.686.
24. Peri-prosthetic fractures around tumor endoprostheses: a retrospective analysis of eighteen cases / N. Barut, P. Anract, A. Babinet, D. Biau // Int. Orthop. 2015. Vol. 39, No 9. P. 1851-1856. doi: 10.1007/s00264-015-2915-3.
Сведения об авторах:
1. Карякин Николай Николаевич - Федеральное государственное бюджетное учреждение «Приволжский федеральный медицинский исследовательский центр» Министерства здравоохранения Российской Федерации, г. Нижний Новгород, Россия, директор, д. м. н.
2. Горбатов Роман Олегович - Федеральное государственное бюджетное учреждение «Приволжский федеральный медицинский исследовательский центр» Министерства здравоохранения Российской Федерации, г Нижний Новгород, Россия, врач травматолог-ортопед травматолого-ортопедического отделения, руководитель лаборатории аддитивных технологий
3. Новиков Антон Евгеньевич - Федеральное государственное бюджетное учреждение «Приволжский федеральный медицинский исследовательский центр» Министерства здравоохранения Российской Федерации, г. Нижний Новгород, Россия, врач онколог, врач травматолог-ортопед травматолого-ортопедического отделения, научный сотрудник научно-клинического отдела
4. Нифтуллаев Руслан Мирмамед оглы - Федеральное государственное бюджетное учреждение «Приволжский федеральный медицинский исследовательский центр» Министерства здравоохранения Российской Федерации, г. Нижний Новгород, Россия, врач-ординатор по специальности «травматология-ортопедия»



