Следующим по значимости и объему после промышленности является применение аддитивных технологий в медицине, на долю которой приходится 17% всего рынка аддитивного производства (АМ).
В реальности существующий уровень использования АМ в медицине пока еще довольно мал, но перспективы его роста огромны. Для этого необходимо внедрять специальный дизайн для АМ в разные сектора производства медицинских изделий, заниматься поиском новых материалов и согласованием новых решений с регулирующими требованиями. И обязательное условие — это продвижение готовых решений через сети дистрибуции и получение отзывов от конечных потребителей и клиентов.
Наиболее широкое применение АМ нашли в стоматологии для изготовления различного рода реставраций, брекетов, вспомогательных элементов и инструментов. Подробно эта тема изложена в [1]. Отдельно следует выделить использование АМ в биотехнологиях, поскольку последние охватывают помимо регенеративной медицины (выращивание тканей и органов для пересадки) огромную сферу искусственных продуктов питания и прежде всего мяса. Другое важное направление, о котором пойдет речь в этой статье — развитие АМ для хирургических и ортопедических целей. По данным Stryker (США, Мичиган, http://stryker.com), в 2018 г. услуги и инновационные продукты в ортопедии, хирургии, нейротехнологиях для позвоночника составили: 13,6 млрд USD — продажи, 36000 работников, 7784 патента, 862 млн USD — затраты на исследования и разработки. Большие возможности появляются с использованием моделирования. Так, школа для слепых и слабовидящих в Индиане (США) использует АМ-технологии для тактильного обучения студентов [2] на моделях. И конечно, это изготовление хирургических инструментов, шаблонов и медицинских приборов.
Развитие хирургии
В 2016 г. FDA одобрила применение 85 разных типов имплантатов, изготовленных с помощью АМ-технологий, за 2018 год это количество выросло [3].
В целом можно сказать, что имплантаты сохраняют свою традиционную форму и функции, а вот технологии их изготовления и внедрения меняются стремительно. В частности, все шире применяются в хирургии роботизированные системы, системы визуализации, дополненной реальности — как для обучения и планирования операций, так и при выполнении самих операций. Для производства имплантатов используются в основном технологические процессы АМ (по приоритету): соединение порошка в ванне (powder bed fusion, PBF), лазерное сплавление (selective laser melting, SLM), лазерное спекание (laser sintering, SLS), сплавление электронным пучком (ele-ctron beam melting, EBM) — [3]. Основное преимущество использования АМ для производства имплантатов — возможность изготавливать сложные сетчатые изделия с меньшим весом, с меньшими затратами в сравнении с традиционными методами. В дополнение АМ позволяет создавать пористую структуру на поверхности имплантата для быстрой остеоинтеграции костной ткани, а также пористую (губчатую) структуру — аналог реальной ткани кости — внутри имплантата.
В 2016 г. компания Smith & Nephew представила свою пористую чашку REDAPT Acetabular с технологией CONCELOC, первым титановым имплантатом ТБС, отпечатанным на 3D-принтере. Полностью пористая структура имплантатов имитирует структуру кости, что обеспечивает быструю остеоинтеграцию и лучшую фиксацию имплантата.
Вслед за Smith & Nephew Stryker запустил свой первый 3D-отпечатанный тазобедренный имплантат — ацетабулярную систему Trident II в марте 2018 года. Имплантат также имитирует структуру кости и обещает многочисленные клинические пре-
имущества, такие как улучшение стабильности сустава и диапазона движений. В 2017 г. DePuy Synthes приобрела технологию 3D-печати у Tissue Regeneration Systems. Имплантаты, изготовленные по АМ-технологии, предполагают более прогрессивные бесцементные методы фиксации. Хотя в Европе применяют более консервативный гибридный подход — используют оба метода фиксации. Преимуществом цементной фиксации является более низкая стоимость имплантата, а также их исключительная применимость в случаях слабой структуры костей или их недостаточности. В то же время большим недостатком цементной фиксации является деградация цемента со временем, что приводит к потере имплантата, а также негативное воздействие материала цемента на окружающие ткани.
Требования к материалу имплантатов помимо высоких механических свойств включают биосовместимость с тканями человека и остеоинтеграцию, например, с костной тканью. Лучшие материалы для металлических имплантатов — это титан и его сплавы (Ti‑6Al‑4V), сплав кобальт-хром и нержавеющие стали (316L). Для более быстрого врастания костной ткани в имплантат на его поверхности создается при печати специальная пористая структура или решетка [4]. Также популярны полимерные материалы — полиэтилен сверхвысокой молекулярной массы (СВМПЭ/UHMWPE), полиэфирэфиркетон (ПЭЭК/PEEK) и цирконий. Для более быстрого прорастания костной ткани в имплантаты из пластика (PEEK) на их поверхность наносят в вакууме плазменное пористое покрытие из титанового сплава.
Реальное АМ-производство и медицина взаимно дополняют друг друга в выборе наилучших решений с точки зрения исследований и получения прибыли, как, например, точность изготовления имплантатов, высокие механические свойства, отсутствие вредных примесей, новые материалы, стерилизация изделий. И здесь, конечно, ведущую роль играют гиганты рынка медицинских изделий: компании Stryker, DePuy Synthes, Smith & Nephew, которые в состоянии проводить дорогостоящие исследования и разработки новых изделий с использованием преимуществ АМ. Вместе с тем растет число небольших компаний, специализирующихся на разработке и производстве нишевых материалов и изделий для ортопедии.
Рынок производителей имплантатов ежегодно растет, что связано как с созданием нормативных требований, предъявляемых к материалам, так и появлением минимально инвазивных процедур и навигационных систем. Кроме того, нет необходимости иметь на складе большие запасы имплантатов разных размеров, поскольку имеется база 3D-файлов таких изделий, и их можно напечатать на 3D-принтере в нужное время.
Новые АМ-технологии с более эффективными операциями и коротким временем восстановления приводят к сдвигу операций от стационара в сторону центров амбулаторной хирургии. Это связано и с растущей конкуренцией на рынке производства эндопротезов и услуг по их установке.
Ожидания специалистов и владельцев бизнесов в медицине связаны с развитием и вовлечением АМ-технологий в производство, обучение, а также в снижение затрат на приобретение 3D-принтеров и соответствующего оборудования (металлический 3D-принтер от компании Markforged стоимостью ниже $100 000, обычная цена металлических принтеров в 5–6 раз выше).
Другая проблема связана с DfAM (design for AM) — нужны подготовленные специалисты, умеющие конструировать на основе компьютерной и магнито-резонансной томографии пациента 3D-цифровую модель нужного элемента для его последующей печати.
Рассмотрим на примере ведущих игроков на рынке применение АМ-технологий для решения различных задач по реставрациям костей и суставов человека как частичных, так и при полной замене.
Челюстно-лицевая хирургия
Одним из первых применений АМ в челюстно-лицевой и черепной хирургии было изготовление протезов костей, которые были разрушены в результате травмы или заболевания. АМ практически не имеет ограничений по форме протеза, его сложности в производстве и позволяет выпускать как мелкие серии стандартных протезов разных размеров, так и индивидуальные протезы для конкретного пациента. В качестве исходной информации для создания такого протеза обычно используются данные, полученные с томографа (КТ или МРТ). Иногда для более точной подгонки протеза используют полимерный макет, выращенный на 3D-принтере. На таком макете можно также подготовить план операции и протестировать его с помощью специального софта (например, FreeForm Modeling от 3D Systems [5]). Процедуры изготовления протезов и их установки достаточно отработаны и описаны во многих публикациях, например [4–6].
1. Индивидуальные черепные реставрации изготавливаются как услуга на основе компьютерной томографии пациента из материалов MEDPOR (биосовместимый пористый полиэтилен) (рис. 1) и PEEK (рис. 2). При этом предел текучести материала имплантата выше, чем реальной кости.
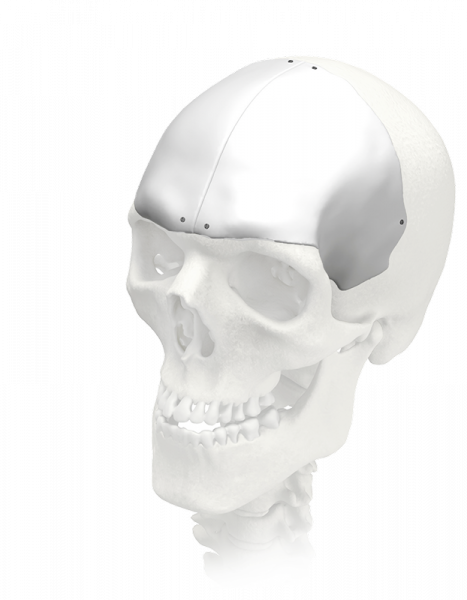
Рис. 1. Черепной имплантат из MEDPOR
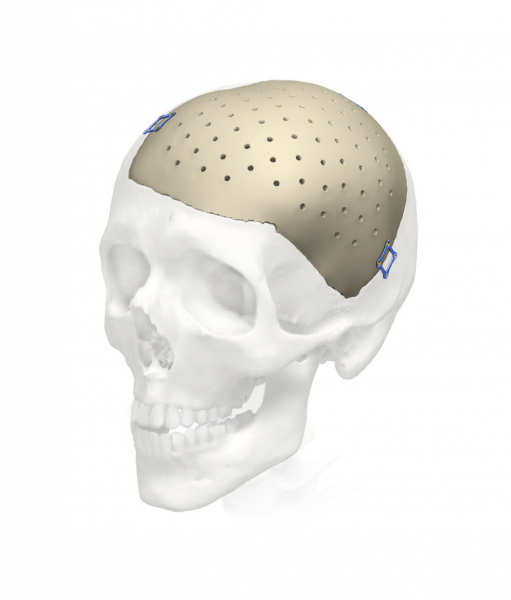
Рис. 2. Черепной имплантат из PEEK
2. Индивидуальные черепные имплантаты (Pterional PLUS, рис. 3, 4) позволяют исправлять естественные дефекты черепа, например, типа асимметрии из-за атрофии тканей.
а) 
б) 
в) 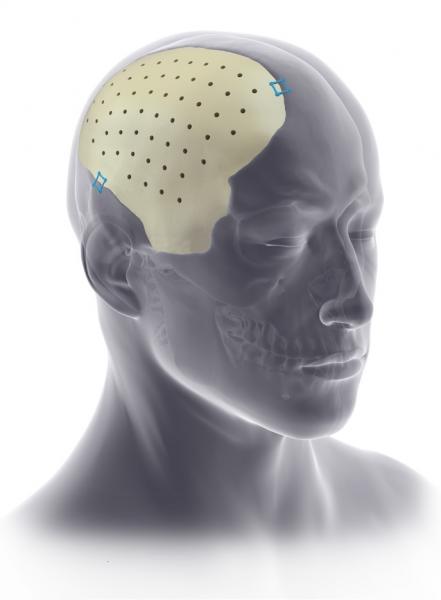
Рис. 3. Установка черепного имплантата: а) черепной дефект, б) стандартный черепной имплантат; в) эстетический имплантат из материала PEEK Pterional PLUS
а)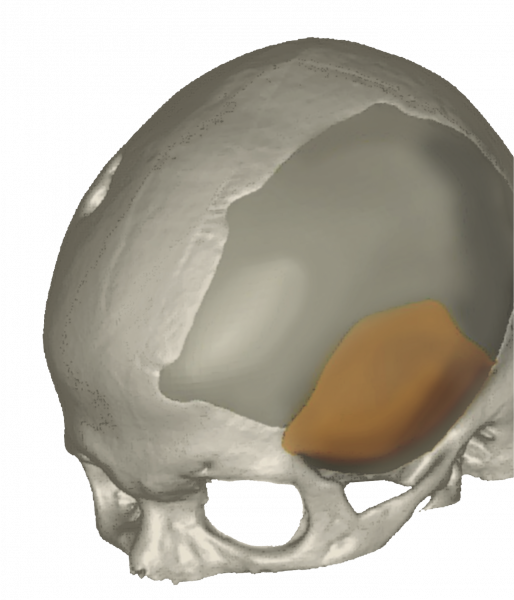
б) 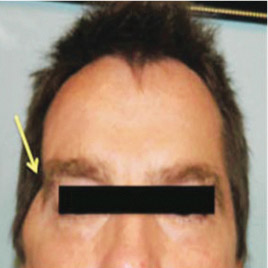 в)
в) 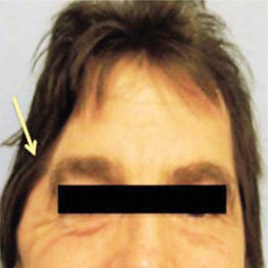
г) 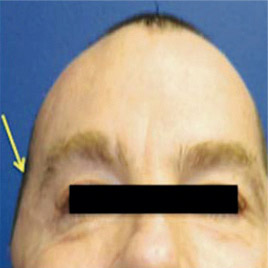
д) 
е) 
ж) 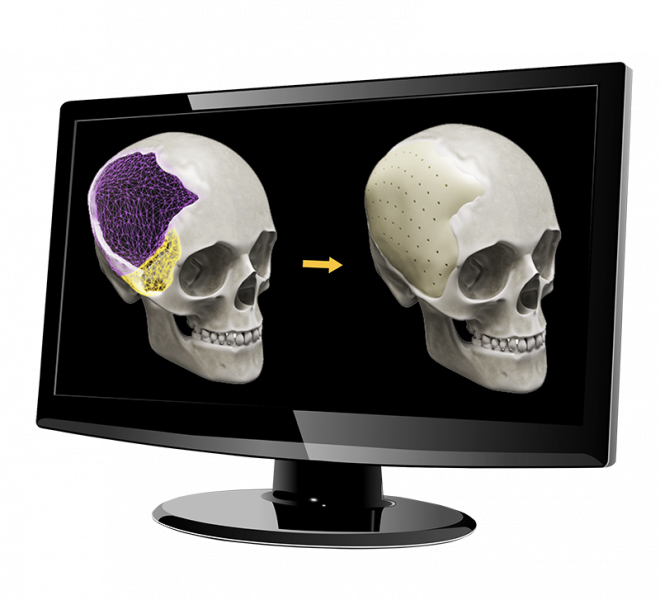
Рис. 4. Установка черепного имплантата: а) конструкция черепного имплантата; б) исходный дефект черепа; в) стандартный черепной имплантат; г) индивидуальный черепной имплантат (Pterional PLUS); д) вид до операции; е) вид после операции; ж) визуализация операции: было — стало
3. Анатомические реконструкции костей лица, включая эстетические задачи (рис. 5).
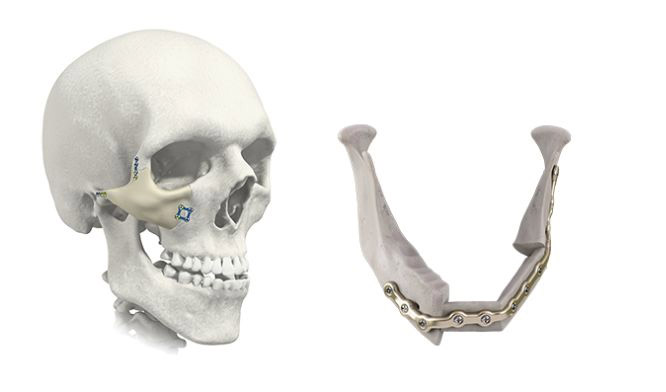
Рис. 5. Реконструкции лицевых костей и челюсти
4. Комбинированный имплантат MEDPOR TITAN 3D для реконструкции черепа состоит из двух частей: основы из сплава титана и покрывающей ее внешней части из пластика MEDPOR (рис. 3в, 4ж).
5. Виртуальное планирование хирургических операций (VSP). Совместный проект с 3D Systems.
Данные компьютерной томографии трансформируются в объемное изображение зоны хирургического вмешательства, что позволяет составить последовательный план операции шаг за шагом. Далее предоперационный пошаговый план вместе с необходимыми пояснениями, руководствами и шаблонами передается бригаде хирургов в операционную комнату. Также можно изготовить на 3D-принтере (SLA-технология) объемные модели черепа с детальным структурным изображением сосудов, корней зубов, возможных опухолей для более точного планирования операции.
6. Внутренняя система дистракции разработана для случаев удаления части кости черепа или лица и предназначена для временной стабилизации и постепенного удлинения лицевых костей черепа с использованием элементов разных производителей (рис. 6).
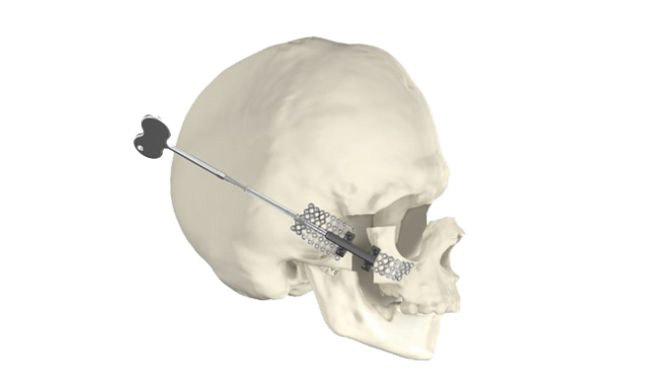
Рис. 6. Пример использования системы дистракции для удлинения лицевой кости черепа
7. Коррекция костей черепа с целью восстановления нарушенной функциональности или по эстетическим причинам очень востребована и дает возможность на основе компьютерной томографии подготовить план операции и успешно выполнить его с использованием плоских и объемных пластин (системы дистракции, рис. 7).

Рис. 7. Коррекция лицевых частей черепа
Реставрация костей и суставов
На металлических 3D-принтерах хорошо освоены и используются технологии печати имплантатов тазобедренного и коленного суставов, позвоночных дисков, костей ноги и других протезов для восстановления разрушенных в результате травм, различных заболеваний костей человека [4, 7].
Растущий тренд показывает рынок имплантатов для суставов плеча (в США в 2016 г. — 100 000 операций по сравнению с 14 000 в 2000 г.) и операции по полной замене лодыжки.
1. Ступня и лодыжка
Модель ступни пациента на основе компьютерной томографии помогает составить план операции для хирурга для устранения дефекта (рис. 8–11).
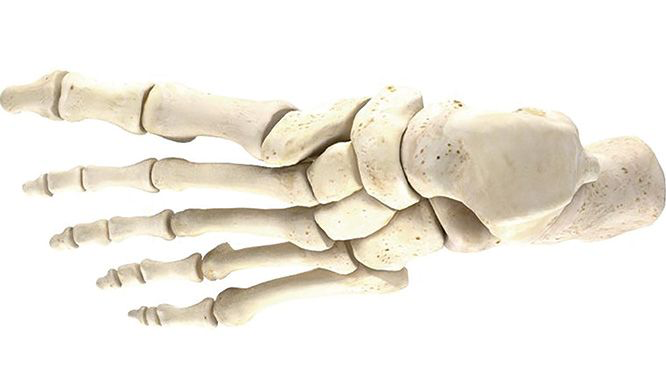
Рис. 8. Кости ступни и лодыжки

Рис. 9. Имплантат лодыжки (STAR™ Ankle)
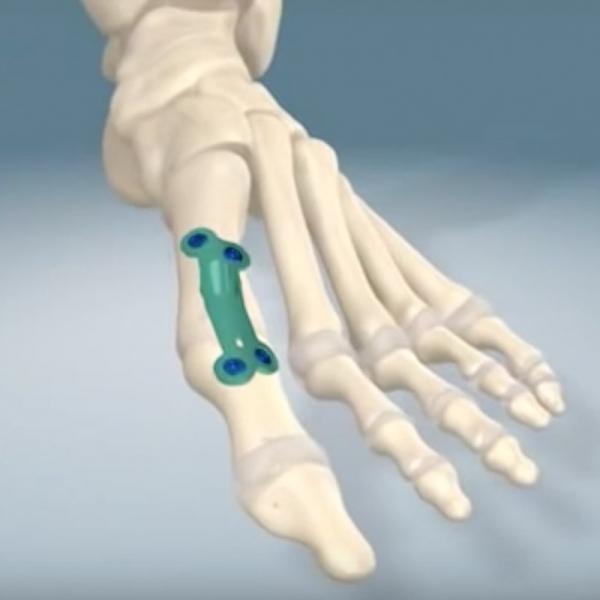
Рис. 10. Лодыжка с установленной накладкой

Рис. 11. Накладки для фиксации костных фрагментов
Лодыжка включает берцовую, таранную и малоберцовую кости. Хирургические операции (The Scandinavian Total Ankle Replacement (STAR™ Ankle) возможны с полной заменой лодыжки в случае различных видов артрита (реальная процедура — см. https://youtu.be/0k693SFNaV4). Имплантат, показанный на рис. 9, применяется в практике в США и Канаде. В случаях перелома отдельных костей лодыжки для фиксации фрагментов используются различные накладки (рис. 10). Подготовленный план операции можно протестировать на 3D-модели лодыжки. Сложная структура костей ступни обусловила разработку хирургических процедур для исправления дефектов каждой из костей фаланг пальцев ноги, костей плюсны, соответствующих суставов. Для их фиксации также используются различные титановые накладки. Место установки и план операции определяются по 3D-модели.
2. Имплантаты тазобедренного сустава (ТБС)
На 3D-принтере чаще всего печатают из сплава титана индивидуальный ТБС: чашку с нанесенным снаружи пористым покрытием (рис. 12), реже ножку с таким же покрытием. Существует несколько вариантов ножек для бесцементного крепления в кости в зависимости от размеров, формы и состояния сустава. Современная конструкция ТБС является результатом многолетней хирургической практики и исследований механики сустава: минимальное трение в шаровом шарнире, малый износ полиэтиленового вкладыша, что обеспечивает длительный срок работы ТБС, большой угол поворота ножки в чашке, надежную фиксацию ножки и чашки в кости, в том числе и за счет остеоинтеграции. Поскольку необходимо соблюдать высокую размерную точность и углы наклона ножки, а также выбрать правильную конусность сопряженных элементов ножки и шарика, то либо элементы ТБС полностью выполняют на 5 координатных станках с ЧПУ, либо на них делают финишную обработку после печати на 3D-принтере. Чашку иногда выполняют из сплава кобальт-хром с последующим плазменным покрытием из титана и затем слоем гидроксилопатита (для лучшей остеоинтеграции, рис. 12). Чашка большего диаметра обеспечивает большую устойчивость с хорошей износостойкостью (~1 мкм в год).

Рис. 12. Имплантат тазобедренного сустава (с улучшенными характеристиками) включает полусферическую ацетабулярную чашку с плазменным покрытием титаном размерами 42–74 мм, с 3–5 отверстиями, полиэтиленовый вкладыш с шаровым шарниром, ножку с пористым покрытием. Возможно нанесение покрытия PureFix HA (hydroxyapatite) для быстрой остеоинтеграции
3. Для первичной установки, или ревизии части, или полной замены коленного сустава могут устанавливаться имплантаты типа TKS (Triathlon Knee System) (рис. 13). TKS-имплантаты изготавливаются по технологии АМ с бесцементной фиксацией (AMagine исследовательский институт в Ирландии занимается изучением АМ-технологий, владелец компания Stryker). Технология полной замены коленного сустава хорошо отработана, дает почти полное восстановление функциональности, а количество операций ежегодно только в США растет на 4,5% (с 1,6 млн операций по замене ТБС и коленного сустава в 2018 г. до 2,1 млн операций в 2024 г., прогноз [2]).

Рис. 13. Имплантат коленного сустава (Triathlon Knee System) с цементной/бесцементной фиксацией
4. Имплантаты для позвоночника компании Zimmer Biomet [8], показаны на рис. 13–15. Пористый танталовый имплантат TM-S (рис. 14) из материала Trabecular Metal аналогичен губчатой структуре кости (пористость до 80%), обладает высоким коэффициентом трения для начальной фиксации и используется как матрица для прорастания костной ткани.

Рис. 14. Пористый танталовый имплантат TM-S из материала Trabecular Metal аналогичен губчатой структуре кости

Рис. 15. Шейный имплантат из биосовместимого полимера PEEK-OPTIMA с метками из танталовых шариков для определения положения по рентгенограмме
На рис. 16 представлен шейный имплантат (ROI–C) с более простой процедурой установки, чем винтовые фиксации.
а) б)
б)
в) 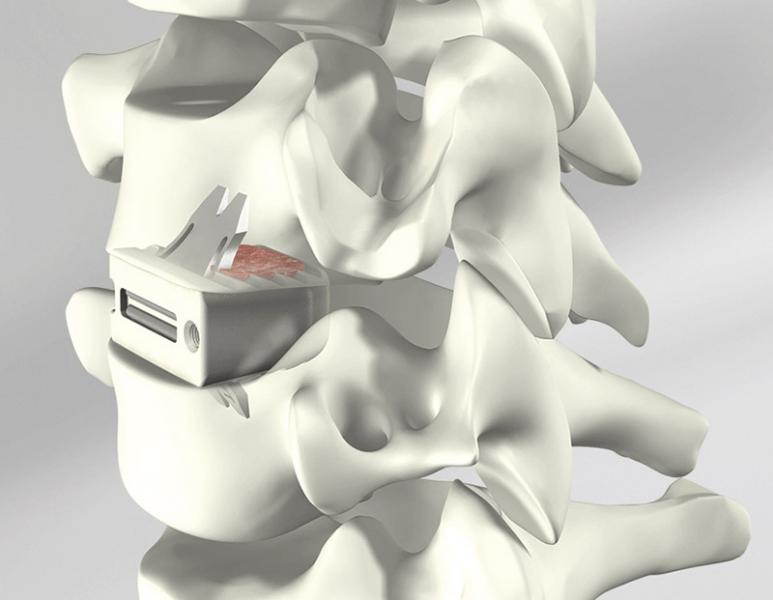
Рис. 16: а) шейный имплантат ROI–C, б) вид в сборе, в) установлен по месту
Компания nTopology [9] также разработала дизайн пористых структур для металлических имплантатов (рис. 17–18) для 3D-печати.

Рис. 17. Имплантат в виде пластины для шейного отдела позвоночника с пористой структурой (а — дизайн, б — пластина после финишной обработки)

Рис. 18. Рабочий стол с напечатанными имплантатами
Протезирование
Рынок протезов растет ежегодно, что связано со старением населения (2017 г. — 960 млн людей свыше 60 лет, 2050 г. — 2.1 млрд), с увеличением количества спортивных травм и травм от занятий йогой, фитнесом, а также от увеличения ампутаций, связанных с заболеваниями диабетом и раком костей. Оценка рынка ортопедических изделий к концу 2024 г. показывает объем в 53 млрд USD c 3% ежегодным ростом начиная с 2017 г. Обусловлено это растущим количеством костных заболеваний — остеопороза и артрита, а также прогрессом в разработке новых ортопедических изделий. При этом США имеют почти 90% рынка ортопедических изделий и услуг в Северной Америке, Германия — почти 20% соответственно в Европе. Мировые лидеры этого рынка — Medtronic, MicroPort Scientific Corporation, ConforMIS, Zimmer Biomet, DJO Global, Stryker.
Создание протеза начинается со сканирования (рис. 19а), это занимает несколько минут и удобно для пациента. После обработки и редактирования рабочий STL-файл отправляется на печать на 3D-принтер. Например, готовый протез ступни состоит из нескольких частей, соединенных специальными брекетами (рис. 19б), рассчитанными для каждого пациента [10].
а) 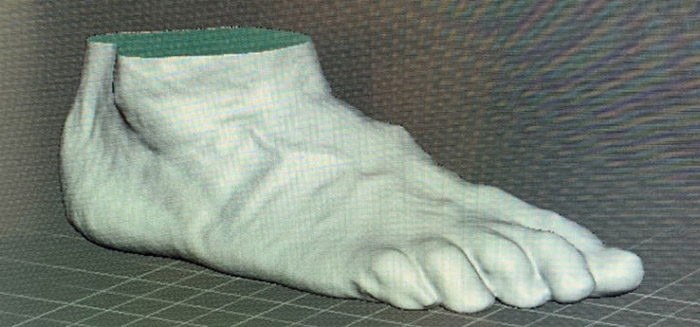 б)
б) 
Рис. 19. Скан (а) и протез (б) ступни
Другой пример: поддержка для шеи (рис. 20а). Необходимость такой поддержки вызвана неестественным положением головы, когда люди часто смотрят в свой смартфон, что приводит к болям в шее, шейному артриту, грыже диска, головной боли, боли в руке и в плече, в нижнем поясничном диске и вызывает суставные изменения. Применение поддержки ежедневно по 20 мин приводит к исправлению положения головы и снимает болевые ощущения (рис. 20б: слева — до применения, справа — с поддержкой).
а) 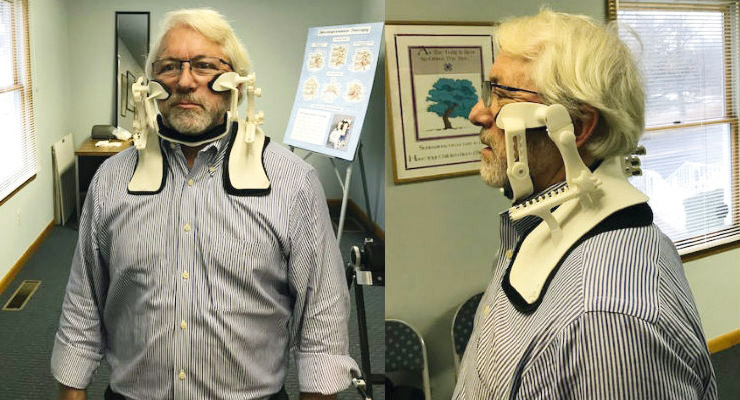
б) 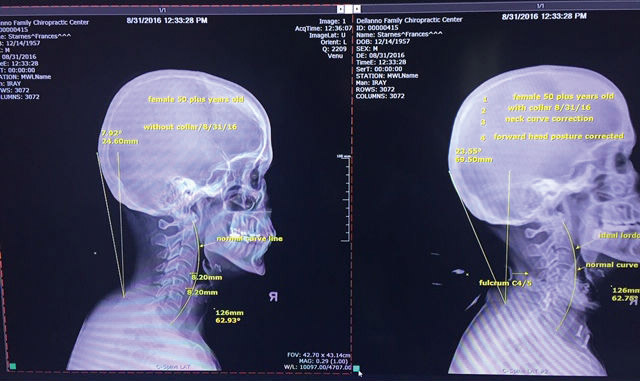
Рис. 20. Поддержка для шеи (а), результаты до применения и после применения (б)
Изготовленный с помощью 3D-печати протез руки с управлением от компьютера (работа Biological Systems Engineering Lab at Hiroshima University [11]) дает более быструю реакцию на движение, легче и дешевле предыдущих изделий, и потому более доступен для пациентов. Обучение движению пальцев похоже на известную игру «камень-ножницы-бумага», где пациенту нужно только подумать о движении соответствующего пальца, и робот автоматически выполнит это движение (рис. 21). Робот является как бы частью тела человека. Электроды протеза фиксируют сигналы от нервных окончаний через кожу (типа ЭКГ сердца), отправляют информацию в компьютер, и в течение 5 миллисекунд робот получает сигнал на соответствующее движение. Таким же образом можно тренировать практически любые движения пальцев для выполнения процедур типа «взять бутылку с водой»; поздороваться за руку с кем-то, контролируя усилие. «Это одна из отличительных особенностей этого проекта. Машина может запоминать простые базовые движения, а затем комбинировать и создавать сложные движения», — говорит руководитель работ профессор Т. Цудзи.
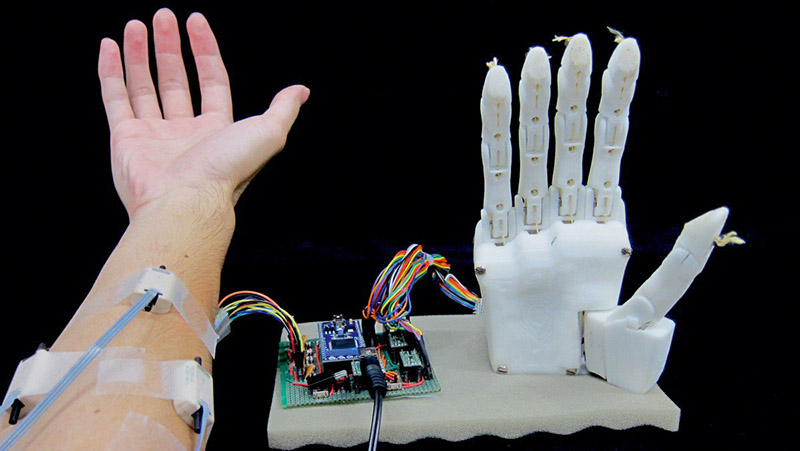
Рис. 21. Протез руки использует сигналы от электродов и машинное обучение для копирования положения руки
Испытания на группе добровольцев показали высокую адаптацию к использованию протеза: точность на уровне 95% для простых движений и 92% для сложных. Однако нынешний вариант протеза руки не годится для постоянного ношения, так как требует сосредоточения внимания на движениях руки, что вызывает мышечную усталость. В дальнейшем команда разработчиков будет работать над решением этой проблемы как в техническом плане, так и в программе тренировки.
Управление по контролю за продуктами и лекарствами США (FDA) дало разрешение на проведение исследований по разработке имплантируемых устройств нового поколения, которые могут быть более полно интегрированы с собственным мозгом пациента. По мнению Скотта Готлиба (доктор медицинских наук, комиссар FDA), «известные как устройства интерфейса мозг—компьютер (BCI), они обладают потенциалом для прямого управления, например, протезом конечности посредством мыслительных процессов пациента. Мы выпускаем проект руководства, чтобы помочь в разработке устройств BCI для пациентов с параличом или ампутацией. Наша цель заключается в разработке политики, которая поощряет использование более новых методов лечения, которые могут резко изменить траекторию здоровья и мобильности».
Как пример наиболее перспективных работ в этом направлении можно рассматривать проект Neuralink И. Маска [12] по созданию масштабируемой широкополосной системы BMI (Brain-machine-interface). В долговременной перспективе, по мнению Маска, это может быть некий симбиоз человека и искусственного интеллекта.
В этом проекте используются новейшие технологии объемного напыления электропроводящих дорожек, микроэлектроника для получения и передачи информации на компьютер, нейрохирургический робот для прецизионной установки нитей в определенные области мозга с точностью позиционирования до 1 мкм.
Система BMI состоит из трех основных компонентов: сверхтонкие полимерные зонды (рис. 22), нейрохирургический робот (рис. 23) для быстрой имплантации 96 полимерных нитей, каждая из которых с 32 электродами, в общей сложности 3072 электрода (рис. 24: игла, картридж и пинчер) и специализированная электроника высокой плотности (рис. 25). Матрица электродов упакована в небольшое имплантируемое устройство, которое содержит 12 микросхем для маломощного встроенного усиления и оцифровки: пакет для 3072 каналов занимает объем 23×18,5×2 мм. Один кабель USB-C обеспечивает потоковую передачу данных с устройства с полной полосой пропускания и одновременную запись со всех каналов.
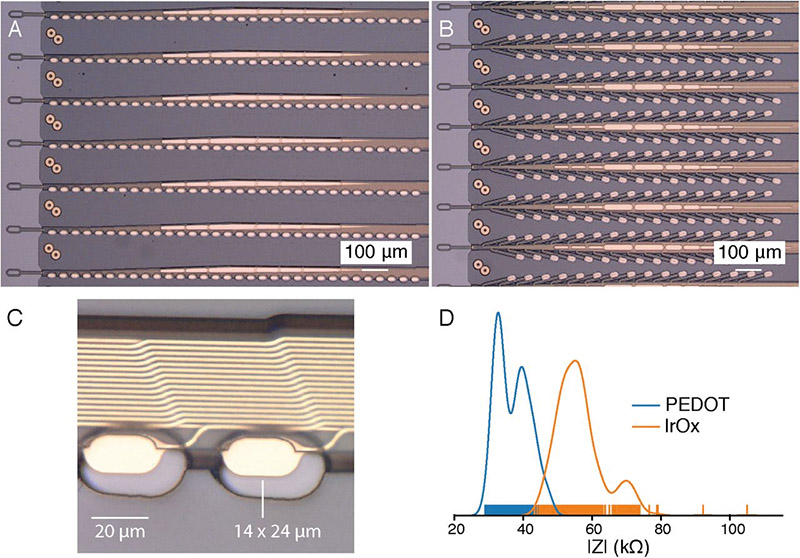
Рис. 22. Полимерные зонды с 32 контактами электродов, разнесенными на 50 мкм или 75 мкм

Рис. 23. Робот для установки нитей. A. Загружен иглодержатель. B. Контактный датчик положения мозга с низким усилием. C. Световые модули с несколькими независимыми длинами волн. D. Игольчатый мотор. E. Одна из четырех камер фокусируется на игле во время введения. F. Камера с широким углом обзора операционного поля. G. Стереоскопические камеры.
Было разработано и изготовлено более 20 различных типов нитей и электродов для имплантации (рис. 24): ширина нити от 5 до 50 мкм, толщина от 4 до 6 мкм, нить включает в себя до трех слоев изоляции и двух слоев проводника. Длина нити около 20 мм. Чтобы обработать эти длинные тонкие нити перед введением, на них наносится полимерная пленка, на которой нити остаются прикрепленными до тех пор, пока хирургический робот их не снимает. Каждая нить заканчивается петлей 16×50 мкм для захвата иглой. Диаметр иглы 24 мкм.

Рис. 24. Игольчатый зажимной патрон (сравнение с монетой): игла — пинчер — картридж
Игла отфрезерована из вольфрам-рениевой проволоки диаметром 40 мкм, электрохимически травленной до диаметра 24 мкм вдоль вводимой длины (рис. 25А). Кончик иглы предназначен как для зацепления петель для введения, так и для проникновения в мозговые оболочки и ткани мозга. Игла приводится в движение линейным двигателем, обеспечивающим переменную скорость введения и быстрое ускорение втягивания (до 30000 мм/с2), что способствует отделению зонда от иглы. Пинчер представляет собой вольфрамовую проволоку диаметром 50 мкм, согнутую на кончике и приводимую как в осевом, так и во вращательном направлении (рис. 25В). Он служит в качестве опоры для зондов во время транспортировки и в качестве направляющей, чтобы гарантировать, что нити вставляются вдоль пути иглы. На рис. 26 показана последовательность фотографий процесса вставки в выделенный отдел мозга.

Рис. 25. Упакованное сенсорное устройство из 12 чипов:
А — индивидуальная нейронная ASIC, способная обрабатывать 256 каналов данных; B — полимерные нити на париленовой основе. C — титановый корпус (крышка снята). D — цифровой разъем USB-C для питания и данных
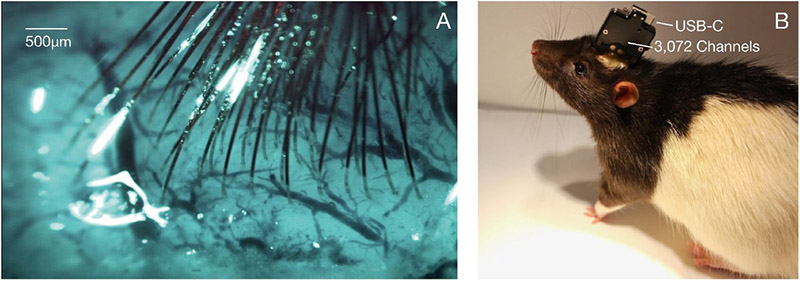
Рис. 26. Имплантация нитей и упаковка: А — пример изображения, показывающего поверхность коры с имплантированными нитями и минимальным кровотечением; B – упакованное сенсорное устройство, имплантированное крысе
Робот работает в автоматическом режиме со скоростью до 6 нитей (192 электрода) в минуту, при этом хирург может выполнять ручную микрорегулировку положения нити перед каждым введением в кору мозга. Система контроля включает 6 независимых световых модулей с разной длиной волны и несколько камер, информация с которых поступает вместе с регистрацией мест введения в общую координатную рамку с ориентирами на черепе. Это в сочетании с отслеживанием глубины позволяет точно выбирать анатомически определенные структуры мозга. Интегрированный пользовательский пакет программного обеспечения позволяет предварительно выбирать все места вставки и планировать пути вставки, чтобы избежать сосудистой сети.
Постоянная запись с тысяч сайтов электродов представляет значительные проблемы с электроникой и упаковкой. Плотность каналов записи требует размещения стека усиления и оцифровки сигнала в сборке массива, в противном случае требования к кабелю и разъему будут чрезмерно высокими. Этот стек записи должен усиливать малые нейронные сигналы (<10 мкВРМС), в то же время подавляя внеполосный шум, дискретизировать и оцифровывать усиленные сигналы и выводить результаты для обработки в реальном времени — все с использованием минимальной мощности и размера. Электроника построена на специализированной интегральной схеме (ASIC) для приложений Neuralink, которая состоит из 256 индивидуально программируемых усилителей («аналоговых пикселей»), встроенных аналого-цифровых преобразователей (АЦП) и периферийной схемы управления для оцифрованных выходов.
Нынешняя система BMI рассматривается как исследовательская платформа для использования на грызунах (рис. 26) и служит прототипом для будущих человеческих клинических имплантатов. Для увеличения пропускной способности потоковой передачи необработанных данных система имеет проводное соединение. В отличие от этого клинические устройства, которые будут производиться от этой платформы, будут полностью имплантируемыми, что требует герметичной упаковки, и будут иметь встроенное сжатие сигнала, пониженное энергопотребление, беспроводную передачу энергии и телеметрию данных через кожу без соединительных проводов.
Эта система имеет несколько преимуществ по сравнению с предыдущими подходами. Размер и состав тонкопленочных зондов лучше соответствуют свойствам материала мозговой ткани, чем обычно используемые кремниевые зонды. Кроме того, возможность выбирать, куда вставлять зонды, в том числе в подкорковые структуры, позволяет создавать собственные геометрии массивов для нацеливания на определенные области мозга, избегая при этом сосудистой сети. Эта особенность важна для создания высокопроизводительной системы, поскольку распределение электродов может быть настроено в зависимости от требований задачи. Наконец, миниатюризация и дизайн Neuralink ASIC обеспечивают большую гибкость в проектировании системы и поддерживают очень высокое число каналов в пределах практического размера и ограничений мощности.
Можно надеяться, что пациент с повреждением спинного мозга мог бы легко управлять цифровой мышью и клавиатурой. В сочетании с быстро совершенствующимися методами стимуляции позвоночника в будущем этот подход поможет восстановить моторную функцию. Нейронные интерфейсы с высокой пропускной способностью должны обеспечивать множество новых терапевтических возможностей.
Важная тема обсуждалась на конференции ASTM [13] — материалы для АМ и их структура в изделиях. Сюда входят:
• свойства материалов, такие как усталость, разрушение, растяжение, износ, коррозия и ползучесть;
• влияние на свойства шероховатости поверхности, ориентацию при построении, термообработку, размеры и формы;
• применимость существующих методов механических испытаний и необходимость разработки новых методов;
• влияние параметров процесса и конструкции изделия на прочностные характеристики (усталость и разрушение);
• оптимизацию процесса построения изделия для улучшения структурной целостности;
• наличие дефектов и критерии приемки;
• прогностические модели зависимости свойств от микроструктуры;
• полномасштабное моделирование поведения усталости и разрушения;
• структурную целостность изготовленных с помощью АМ биоматериалов (титановых и кобальт-хром сплавов, нержавеющей стали, никель-титановых сплавов и т. д.)
Экзоскелеты
История экзоскелетов (ЭС) начинается с 1890 г., а первый прототип был представлен в 2005 г. Потребность в ЭС есть у военных, в медицине и в промышленности. Задача ЭС помочь собственной мускулатуре человека, или добавить мощности, или и то, и другое вместе. Сейчас на рынке предлагается 10 различных типов ЭС со средней ценой $70000, которая слишком высока для большинства нуждающихся. Тем не менее емкость рынка ЭС к 2025 г. оценивается в 3,3 млрд USD.
В частности, в вооруженных силах США применяется ЭС TALOS (Tactical Assault Light Operator Suit) с питанием от батареи и предназначенный для защиты жизни солдат на передовой. Особенность ЭС в использовании жидких материалов, которые мгновенно становятся твердыми при попадании в них пули (рис. 27).

Рис. 27. Экзоскелет армии США
Заключение
По мнению специалистов, АМ реально преобразовывают медицину на наших глазах. Но если персонификация по заказу и выращивание органов и тканей из клеток — это перспективы десятилетия, то планирование и изучение хирургических операций с использованием моделей, напечатанных на 3D-принтере для конкретного пациента по КТ или МРТ данным, уже широко используется. Такая предварительная подготовка экономит дорогостоящее время операции и позволяет избежать ошибок и риска внесения инфекции, уменьшить потери крови и т. п. ■
Литература
1. Н. М. Максимов. Аддитивные технологии в стоматологии // Аддитивные технологии. 2019. № 1. С. 34–41.
2. https://www.3dprintingsolutions.com.au/News/Australia/3d-printing-in-blind-education
3. https://clck.ru/HRoZM
4. https://www.concept-laser.de/en/industry/medical.html
5. https://www.3dsystems.com/sites/default/files/2018–09/3d-systems-freeform-whatsnew-en-a4‑web‑2018–09–19.pdf
6. А. В. Евсеев и др. Применение лазерной стереолитографии в медицине // Аддитивные технологии. 2019. № 2. С. 56.
7. https://clck.ru/HTUsw
8. https://www.zimmerbiomet.com/medical-professionals/spine.html
9. https://ntopology.com/medical/
10. http://braceguy.com/
11. https://clck.ru/HMMGu
12. https://clck.ru/HNY4F; https://clck.ru/HNYA2; https://doi.org/10.1101/703801
13. http://tinyurl.com/ydhal5ub
Автор Н.М. Максимов, ООО «Ника-Рус»
Источник журнал "Аддитивные технологии" № 3-2019



