Введение
Внедрение в практику здравоохранения информационных технологий значительно изменяет способы диагностики и лечения, формы взаимодействия врачей с пациентами и коллегами, организацию лечения и восстановления здоровья. Современная цифровая медицина, позволяющая повышать доступность, качество и эффективность медицинской помощи, — один из приоритетных проектов стратегического развития российского здравоохранения, разработанных Минздравом РФ.
Развитие современного трехмерного моделирования и внедрение нового поколения спиральных компьютерных томографов значительно расширило возможности использования этих информационных технологий в реконструктивной хирургии [1–4]. Специализированное программное обеспечение позволяет оперативно производить обработку томографических данных пациента и создавать цифровые трехмерные модели любого дефекта или зоны патологии. Цифровые модели все активнее используются при подготовке и планировании оперативного вмешательства в челюстно-лицевой хирургии, хирургии шеи и позвоночника, торакальной хирургии, ортопедии и нейрохирургии. Их можно напрямую использовать для создания копий патологий и дефектов конкретного пациента с помощью аддитивных технологий [1]. Персонифицированные пластиковые копии анатомических структур позволяют проводить эффективное предварительное планирование сложных операций. На основе цифровых моделей дефектов или зон патологий конкретных заболеваний человека можно создавать единые базы данных для интеллектуальных систем поддержки принятия врачебных решений.
Сегментация томографических данных
Основное назначение томографического исследования — это медицинская диагностика, уточнение диагноза или отслеживание результатов лечения. Оно позволяет выявить наличие патологии и получить о ней дополнительную информацию. В большинстве случаев это делается путем последовательного визуального анализа изображения срезов, сформированных компьютерным томографом. В настоящее время с помощью специализированных программ уже доступно формирование трехмерной реконструкции томографических данных, которая позволяет значительно улучшить выявление патологий и проводить предварительное планирование сложных хирургических операций. Однако создание трехмерной реконструкции требует решения целого ряда задач, поскольку интересующие структуры и окружающие их ткани имеют сходную плотность и плохо различаются на томографических изображениях. В подобных случаях возникает необходимость в такой операции, как сегментация — программное выделение интересующих структур в требуемых границах с последующей их визуализацией, анализом и экспортом в виде файла цифровой модели.
Цифровая модель открывает дополнительные возможности:
• предоперационное моделирование высокоточных шаблонов и имплантатов на основе томографических данных конкретного пациента,
• изготовление с помощью аддитивных технологий копий дефектов и патологий для дальнейшего анализа и планирования операции,
• 3D-печать биологических тканей и матриксов для непосредственного восстановления дефекта.
Базовые алгоритмы сегментации
Описание основных алгоритмов сегментации сделано на основе анализа работы программы «Инобитек DICOM Просмотрщик» [5].
Основная задача сегментации заданной области и выделения требуемой структуры — это удаление всех остальных объектов на трехмерной реконструкции, полученной по томографическим данным [6]. В первую очередь устанавливаются пороговые значения плотности выделяемых тканей. В этом случае используются два алгоритма: цветовая таблица и маска видимости.
В томографическом изображении градация серого цвета соответствует конкретному значению плотности биологической структуры. Для цветовой сегментации реконструкции определенному диапазону плотности можно назначить конкретное значение цвета и видимости. Для этого формируется цветовая таблица, которая задает конкретной плотности значение цветового диапазона. В зависимости от выбранной цветовой таблицы плотности одного диапазона, соответствующие одному типу тканей, могут быть скрыты, а плотности других диапазонов, наоборот, сделаны видимыми и окрашены в выбранный цвет. Таким образом, разные цветовые таблицы позволяют проводить сегментацию и визуализировать разные органы и ткани (рис. 1).
![Рис. 1. Пример сегментации с использованием цветовых таблиц, программа «Инобитек DICOM Просмотрщик» [5]](/sites/default/files/Images/Public/statia_formirovanie_cifrovix_modelei_dla_at_ris1_at_2_2022.jpg)
Рис. 1. Пример сегментации с использованием цветовых таблиц, программа «Инобитек DICOM Просмотрщик» [5]
Другим параметром, определяющим текущую сегментацию, является маска видимости. В этой маске каждому пикселю соответствует один бит, который, соответственно, может иметь значение: 0 — пиксель не отображается, 1 — пиксель отображается при визуализации. Следовательно, сегментация изображений определяется тремя основными параметрами: цветовой таблицей, окном плотности и маской видимости.
Основные инструменты сегментирования
1. Вырезание сегментированной структуры с помощью полигона. Инструмент применяется к трехмерной реконструкции. Возможны два варианта: удалить всё попавшее в выделенную область или, наоборот, удалить всё вокруг выделенной области.
2. Стирание или прорисовка требуемых структур изображения инструментом задаваемого размера в виде шара или цилиндра. Преимуществом этого инструмента является его локальность: всегда можно подобрать такой размер инструмента, чтобы удалить только то, что требуется. Кроме того, этот инструмент можно применять на двумерных срезах реконструкции, что позволяет выполнять посрезовую ручную сегментацию нужной структуры.
3. Выделение связанных областей. Для этого задается понятие минимальной толщины структуры, делающей объект связным, т. е. если две части объекта связаны некоторой структурой, толщина которой меньше указанного значения, то эти две части не будут считаться связными.
4. Морфологические операции — наращивание или сокращение объема реконструкции, позволяющие нарастить или сократить текущую сегментацию на заданное количество вокселей. Для удобства пользователя величина наращивания/сокращения задается в миллиметрах.
5. Сегментированные структуры позволяют проводить между ними бинарные операции: вычитание, пересечение, объединение. В любой из этих операций участвуют две сегментированные структуры. При вычитании из маски видимости целевой структуры вычитаются все воксели маски сегментации дополнительной структуры, в результате все видимые воксели дополнительной структуры становятся невидимыми в целевой структуре. При пересечении в маске видимости целевой структуры остаются только воксели, присутствующие одновременно в маске сегментации целевой и дополнительной структуры. При объединении в маску видимости целевой структуры добавляются все воксели маски сегментации дополнительной структуры.
Сегментированная структура — это сохраненный результат сегментации, который можно редактировать и визуализировать независимо от других частей реконструкции. На основе любой сегментированной структуры можно построить ее цифровую модель — аппроксимацию поверхности сегментированной структуры полигональными элементами (треугольниками). Это один из самых важных результатов сегментации, так как экспорт результатов сегментации в виде полигональной модели позволяет работать с ними в большинстве программ трехмерного моделирования и 3D-печати. Для построения сеток используется алгоритм «марширующих кубов», являющийся одновременно простым и наиболее эффективным для данной задачи (рис. 2).
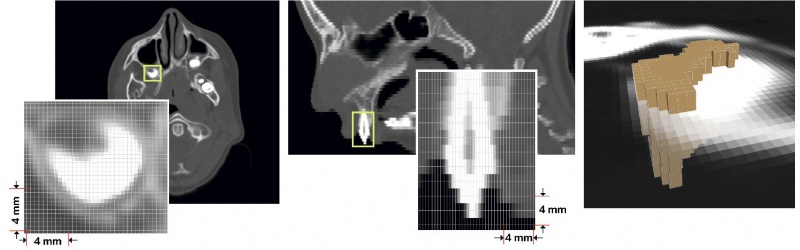
Рис. 2. Данные томографического изображения: от пикселей до вокселей
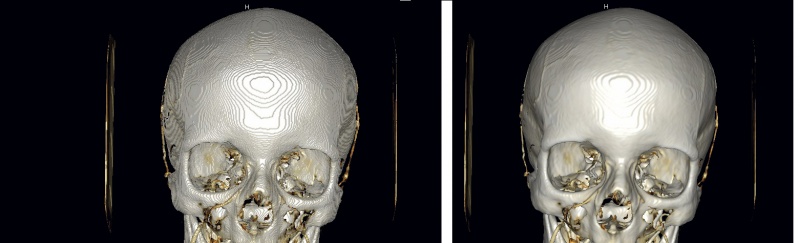
Рис. 3. Сглаживание поверхности воксельной модели методом Лапласа
Трехмерная модель, построенная на основе томографических изображений, состоит из кубических вокселей, и поэтому полигональная сетка, полученная при аппроксимации ее поверхности, выглядит ступенчатой. Сглаживание поверхности производится методом Лапласа, при котором координаты каждой вершины сетки заменяются усредненной координатой всех соседних вершин. Результат этой процедуры представлен на рис. 3.
Сегментация с использованием нескольких исследований
Интересным способом выделения нужных объектов, разработанным в программе «Инобитек DICOM Просмотрщик», является использование данных, полученных в разных томографических исследованиях. Классическим примером такой задачи является отделение кровеносной системы с введенным контрастом от костных структур, так как рентгеновская плотность контрастного агента в КТ сравнима с рентгеновской плотностью костных структур. В этом случае задача сводится к сегментации костных структур в серии без контраста и дальнейшем вычитании полученной сегментации из серии с контрастом (рис. 4).
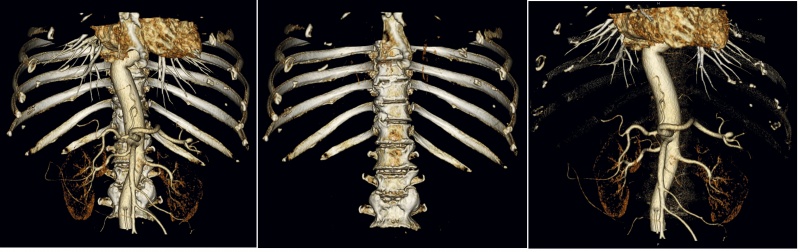
Рис. 4. Серия с контрастом, серия без контраста, вычитание
Основной проблемой в этом случае является пространственное совмещение данных из разных исследований. Это метод может иметь большое значение для будущего развития сегментации при комбинации разных способов исследования: КТ, МРТ и ПЭТ-томографии.
Совмещение различных типов обследования в 3D-реконструкции
Новая технология ядерной медицины ПЭТ получает картину биохимической активности, детектируя в теле человека радиоактивные изотопы, и предназначена в основном для обнаружения раковых опухолей. Но, основываясь на ПЭТ, трудно понять, в какой части тела находится область с максимальной концентрацией радиоактивного вещества. КТ-исследование помогает получить анатомическую структуру человеческого тела. При соединении геометрии тела КТ (рис. 5а) и областей, насыщенных кровью с высокой концентрацией радиоактивного вещества ПЭТ (рис 5б), получаем объединенную трехмерную реконструкцию (рис. 5в).
а) ![Рис. 5. Совмещение различных типов обследования в 3D-реконструкции [7]](/sites/default/files/Images/Public/statia_formirovanie_cifrovix_modelei_dla_at_ris6-1_at_2_2022.jpg)
б) ![Рис. 5. Совмещение различных типов обследования в 3D-реконструкции [7]](/sites/default/files/Images/Public/statia_formirovanie_cifrovix_modelei_dla_at_ris6-2_at_2_2022.jpg)
в) ![Рис. 5. Совмещение различных типов обследования в 3D-реконструкции [7]](/sites/default/files/Images/Public/statia_formirovanie_cifrovix_modelei_dla_at_ris6-3_at_2_2022.jpg)
Рис. 5. Совмещение различных типов обследования в 3D-реконструкции [7]
Программы обработки и конвертация изображений формата DICOM в трехмерную модель формата STL
Для оценки возможностей таких программ были рассмотрены несколько коммерческих и свободно распространяемых продуктов (таблица 1).

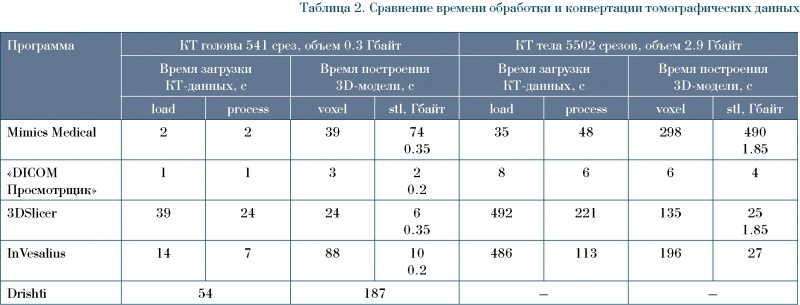
Обработка томографических данных двух видов для оценки быстродействия проводилась на компьютере со следующей конфигурацией: процессор AMD Ryzen 7 PRO 3700 8-Core Processor: тактовая частота 3.60 GHz, оперативная память DDDR4 32 Гбайта, видеоплата Radeon RX 570 Series 4 Гбайта.
Краткое сравнительное описание возможностей программного обеспечения
Mimics Medical. Отличные функциональные возможности, хорошо проработанный интерфейс, широкие возможности по сегментации изображений, высокая стоимость лицензии.
«DICOM Просмотрщик». Хорошие функциональные возможности, хорошо проработанный интерфейс, широкие возможности по сегментации изображений, удобная работа с воксельной моделью, высокое быстродействие, доступная стоимость лицензии.
3DSlicer. Достаточные функциональные возможности, модульный интерфейс, достаточные возможности по сегментации изображений, много готовых конфигураций для специализированных задач, бесплатная лицензия.
InVesalius. Хорошие возможности для начального уровня, модульный интерфейс, недостаточные возможности по сегментации изображений, бесплатная лицензия.
Drishti. Отдельные программы чтения и обработки, проблемы с чтением данных формата DICOM, модульный интерфейс, недостаточные возможности по сегментации изображений, бесплатная лицензия.
На рис. 6 представлены картинки моделей в формате STL.
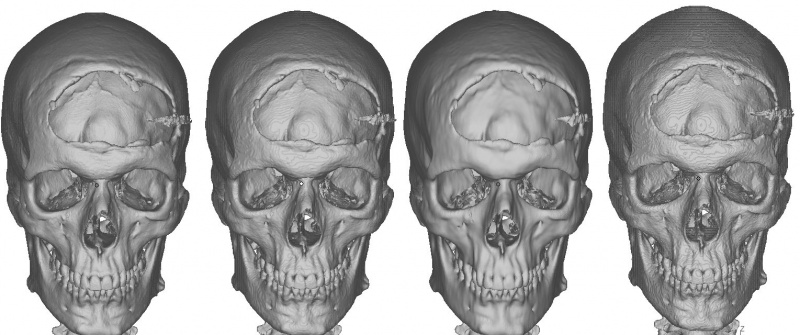
Рис. 6. Примеры моделей, построенных по томографическим данным, слева направо результат программы: Minics, «DICOM Просмотрщик», 3DSlicer, InVesalius
Вопросы сертификации
Специальных стандартов и сертификации цифровых моделей в медицине в РФ на сегодня не разработано. Для применения цифровых моделей можно использовать пункт 5 статьи 38 «Медицинские изделия», федеральный закон от 21 ноября 2011 г. N 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации»: «Медицинские изделия, которые изготовлены по индивидуальным заказам пациентов, к которым предъявляются специальные требования по назначению медицинских работников и которые предназначены исключительно для личного использования конкретным пациентом, а также медицинские изделия, предназначенные для использования на территории международного медицинского кластера или на территориях инновационных научно-технологических центров, государственной регистрации не подлежат. На указанные медицинские изделия не распространяются положения части 3 настоящей статьи, предусматривающие разработку производителем (изготовителем) медицинского изделия технической и (или) эксплуатационной документации». Дополнительно это подтверждается постановлением правительства РФ от 27.12.2012 № 1416 «об утверждении правил государственной регистрации медицинских изделий» и письмом Федеральной службы по надзору в сфере здравоохранения от 21.07.2015 г. № 04–21338/15.
Таким образом, цифровые модели и индивидуальные медицинские изделия, изготовленные с использованием 3D-печати по антропометрическим показателям конкретных пациентов, не подлежат государственной регистрации. Исходя из буквального толкования вышеуказанных норм закона, следует, что государственной регистрации подлежит материал, из которого изготавливаются индивидуальные медицинские изделия. При этом пока не разработано четких регламентирующих законов, касающихся качества цифровых моделей, стандартизации материалов и процессов в области производства с использованием технологий 3D-печати, для обеспечения безопасности объектов, печатаемых на 3D-принтере при их использовании в медицинских целях.
Американское Федеральное управление по надзору за качеством пищевых и лекарственных препаратов (FDA) в 2017 году выпустило рекомендации по созданию медицинских моделей с помощью 3D-принтеров. Рекомендации включают разделы по дизайну и процессу производства, испытанию моделей и составлению инструкций. При создании моделей на основе изображений, полученных при КТ-сканировании, должны учитываться минимальное качество изображения и его разрешение, алгоритмы обработки изображений, которые могут изменять размеры модели по сравнению с реальными органами, а также сохранность и определимость анатомических ориентиров, используемых для адаптации модели. В разделе по испытанию моделей приводятся требования к их описанию, результатам механических испытаний, измерению размеров, характеристикам материала, стерилизации и биосовместимости. Каждое устройство должно иметь инструкцию, где будут указаны идентификатор пациента, назначение модели и его окончательный дизайн, а также предупреждение о необходимости предварительного обследования пациента для исключения любых изменений, которые могут отличать модель от реальной анатомической структуры.
Правовое регулирование использования медицинских изделий, созданных с использованием аддитивных технологий в Евросоюзе. Контроль оборота и применения того или иного изделия медицинского назначения в европейских странах регламентируется различными директивами совета ЕС: 90/385/EEC об активных имплантируемых медицинских устройствах, 93/42/EEC о медицинских приборах, 98/79/ EEC о диагностических медицинских приборах in vitro. Медицинские изделия, в частности custom-made имплантаты, созданные с использованием аддитивных технологий, относятся к классу 3 безопасности и не нуждаются в прямой сертификации. В последнее время европейские регуляторные органы в сотрудничестве с американским международным обществом по испытанию материалов (American Society for Testing and Materials) также пытаются усовершенствовать процесс стандартизации 3D-печати в рамках ISO и перерабатывают европейские стандарты по контролю использования custom-made изделий.
Заключение
Описанные в данной статье инструменты и подходы являются универсальными и могут быть использованы для сегментации любых анатомических структур. При потоковой диагностике может стоять задача сегментации одних и тех же органов на основе данных одного типа исследования много раз подряд. В этом случае использование универсальных инструментов может быть не самым быстрым и удобным способом сегментации, и в таких задачах эффективнее использовать специализированные инструменты. Специализированный инструмент сегментации может быть реализацией шаблона применения универсальных подходов, либо же это специально разработанные для конкретного случая алгоритмы и методы. Следующей задачей данной работы является разработка специализированных инструментов и улучшения их функционала. Проведенный сравнительный анализ позволяет из протестированных программ обработки и конвертации изображений формата DICOM в трехмерную модель формата STL рекомендовать к использованию «DICOM Просмотрщик Инобитек» и 3DSlicer. ■
Литература
- Ипполитов Е.В., Новиков М.М., Черебыло С.А., Евсеев А.В. Применение лазерной стереолитографии в медицине // Коллективная монография: Современные лазерно-информационные технологии. Под ред. В. Я. Панченко и Ф. В. Лебедева. М.: Интерконтакт Наука, 2015. С. 358–373. ISBN 978–5–902063–52–0.
- Максимов Н.М. Аддитивные технологии в хирургии и ортопедии // Аддитивные технологии. 2019. № 3. С. 30–39.
- Мирзоев М.Ш., Шакиров М. Н., Хушвахтов Д. И., Джонибекова Р. Н., Григорьев Е. Г. Устранение дефектов нижней челюсти эндопротезами, созданными по технологии аддитивного стереолитографического моделирования //Вестник Авиценны. 2018. 20 (2–3):170–175. https://vestnik-avicenna.tj/upload/global/4_170–175.pdf
- Максимов Н.М. Применение АМ в биотехнологии. Аддитивные технологии. 2020. № 2. № 3. № 4.
- https://habr.com/ru/company/inobitec/blog/358136/
- Мусатян С.А., Ломакин А. В., Сартасов С. Ю., Попыванов Л. К., Монахов И. Б., Чижова А. С. Способы сегментации медицинских изображений. Труды ИСП РАН. Том 30. Вып. 4. 2018. С. 183–194.
Автор: Михаил Михайлович Новиков, novikov@rambler.ru, тел.: (49645) 22200 доб. 459.
Институт проблем лазерных и информационных технологий РАН – филиал федерального государственного учреждения «Федеральный научно-исследовательский центр «Кристаллография и фотоника» Российской академии наук, г. Шатура
Источник журнал "Аддитивные технологии" № 2-2022



